I-INTRODUCTION
Cet article fournit une brève introduction aux paramètres les plus importants impliqués dans les systèmes multiphases.
En introduction, les forces qui interagissent entre les molécules individuelles sont brièvement mentionnées, suivies d'un bref examen des facteurs responsables de la formation et de la stabilité des systèmes constitués de deux phases incompatibles, comme illustré par les émulsions et les pâtes à gâteau. Ceci illustre comment les forces liées aux substances amphiphiles telles que les émulsifiants alimentaires peuvent être considérées comme des aliments complexes au niveau moléculaire, ou comment des modèles d’aliments peuvent être formulés et décrits pour avoir une idée de la façon dont les émulsifiants alimentaires peuvent agir au niveau des aliments complexes et tirer profit des émulsifiants. Les aliments et les produits alimentaires sont composés d'un très grand nombre de types de molécules. La plupart des aliments sont des amalgamâtes de nombreux constituants, allant de molécules de petite taille à des biopolymères beaucoup plus gros, qui forment ensemble l'aliment composé. Cela signifie qu'une substance ou un composant individuel sera associé à un certain nombre de substances similaires ou différentes ou les deux types en même temps. Elles donneront à l’aliment sa texture, ses caractéristiques sensorielles, etc. Dans le produit alimentaire, des composants individuels peuvent être présents sous différentes formes - soit de constituants similaires, soit d'un mélange de composants discrets. Souvent, ils seront organisés en entités structurelles distinctes à l'interface entre différentes phases ou peuvent être dispersés sous forme de corps accumulés ou d'agrégats distincts dans une phase en bloc. Les composants de l'aliment peuvent également être des éléments d'un réseau tridimensionnel interne, formant une structure intégrée et conférant ainsi à l'aliment les propriétés physiques et chimiques caractéristiques reconnues comme texture et profil organoleptique. Cela signifie que les propriétés des aliments proviennent des substances présentes. En raison des interactions et des forces intermoléculaires combinées à des facteurs externes tels que la température, le stress, etc., elles se combinent pour former des organisations structurelles telles que les dispersions, les mousses, les émulsions, les gels et autres systèmes composites. Au niveau moléculaire, les molécules individuelles interagiront en raison d’un certain nombre de forces attractives et répulsives entre les molécules (voir Tableau 1). Ces forces sont reconnues comme des forces de Van der Waal et comparées aux forces intramoléculaires (c.-à-d. aux liaisons covalentes), sont environ une vingtaine de fois plus faibles. Cependant, bien que faibles, ils jouent un rôle important dans l’interaction au sein des composés voisins. Les forces de Van der Wall peuvent être classées en trois groupes distincts: les forces d'orientation, les forces de Debye et les forces de Londres.
Tableau 1 : Exemples de types de forces moléculaires et intermoléculaires
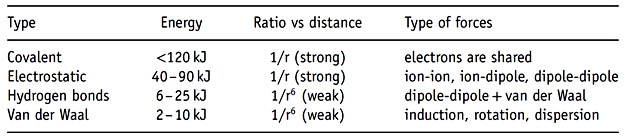
Les forces d'orientation tire leur origine de l'interaction électrostatique résultant de distributions de charges asymétriques au sein de molécules électriquement neutres - un déplacement de charge provoquant un moment dipolaire permanent. La présence d'un moment dipolaire permanent induira une interaction électrostatique entre les composants chargés ou les molécules possédant un moment dipolaire et devient ainsi un paramètre fondamental dans l'orientation des substances ainsi que dans les arrangements et l'organisation moléculaires. La présence d'un moment dipolaire dans une substance peut interagir avec d'autres molécules en induisant un moment dipolaire au sein des substances voisines, ce qui permet d'établir des forces d'attraction ou de répulsion entre les substances. Dans ce cas, les forces sont reconnues comme forces de Debye. Une interaction de voisinage peut également avoir lieu lorsqu'un ion dissous, du fait de la présence de la charge électrique, induit une distorsion électronique d'un composé non polaire et, ainsi, transforme le composé en une substance polarisée. La troisième catégorie regroupe les forces de Londres, qui proviennent des mouvements d'électrons au sein d'une molécule. Les fluctuations des électrons génèrent une oscillation d'une charge négative, formant des moments dipolaires au sein de la molécule, et le moment dipolaire interagira avec des molécules voisines présentant une attraction faible ou, si la charge est similaire, une répulsion.
La liaison hydrogène est une force importante qui peut interagir entre les molécules et avoir un pouvoir entre les faibles forces de Van der Waal susmentionnées et les forces d'une liaison covalente. La liaison hydrogène est une liaison non covalente formée à partir d'interactions intramoléculaires et intermoléculaires entre un donneur de proton et un accepteur de proton, ce dernier étant un atome ou un fragment d'électronégativité supérieure à celle du donneur. Comme mentionné ci-dessus, la liaison hydrogène peut-être une liaison intramoléculaire mais dans le cas de systèmes colloïdaux et alimentaires elle peut être une attraction ou une liaison intermoléculaire entre des composés individuels. La liaison hydrogène est formée par interaction entre un donneur d'électrons et un centre déficient en électron et la force de la liaison est déterminée à partir de la longueur, avec une décroissance exponentielle par rapport à la distance entre les substances. De plus, l'angle de liaison a une influence sur la force de liaison.
Les liaisons hydrogènes ne sont pas de simples liaisons, mais sont considérées comme étant en partie électrostatiques et en partie covalentes de nature. La liaison hydrogène peut-être montrée par des méthodes spectroscopiques (par exemple IR, UV et RMN) expliquant ainsi point d’ébullition extrêmement élevé de l’eau et de plusieurs solvants organiques. Il convient également de mentionner les interactions donneur et accepteur de paires d'électrons dont l’origine est la présence d'orbitales moléculaires occupées par des électrons de haute énergie et de faibles énergies. De plus, une interaction solvophobe, qui est l'inclusion d'une substance hydrophile dans l'eau, doit être prise en compte. De l’interaction entre deux molécules à un système composé de nombreuses molécules et où les matériaux sont organisés en structures ou corps formés d’un grand nombre de molécules associées, l’interaction entre les différents corps colloïdaux peut être simplifiée en forces attractives et répulsives entre corps colloïdes individuels. L'interaction entre les corps colloïdaux provient des forces moléculaires et constitue une intégration de l'interaction entre toutes les molécules des corps colloïdaux, ainsi qu'une interaction à partir de molécules du milieu environnant. Cela signifie que, dans les colloïdes, l'interaction entre les particules colloïdales individuelles provient des mêmes forces que celles mentionnées ci-dessus. Cependant, les interactions globales entre les différents corps colloïdaux sont déterminées à partir de la nature des corps et du solvant environnant, chacun représentant un très grand nombre (et souvent une très grande variété) de molécules.
Dans un système multiphase, l'interaction entre les particules discrètes est liée à deux forces principales, selon la théorie DVLO de Derjaguin & Landau et Verweg & Overbeek. Ici, l’interaction connue de Van der Waal (c’est-à-dire les forces qui dérivent des instants dipolaires fluctuants des atomes neutres) provoque la polarisation d’autres atomes et peut donc établir une attraction entre les particules, jouant ainsi un rôle moteur dans la floculation en corps plus grands. La deuxième force est la répulsion électrostatique entre les doubles couches, qui est associée à une charge électrique, comme dans le cas des substances ioniques. Les forces vont neutraliser et équilibrer l’interaction de Van der Waal et stabiliser ainsi le système colloïdal (c’est-à-dire empêcher le colloïde de se crémer et / ou de floculer). Du point de vue thermodynamique, le système est instable, mais les forces qui s'opposent entre les particules placent le système dans un état métastable qui est donc cinétiquement stable. Outre les deux forces majeures de la théorie DVLO, des modèles plus détaillés incluent une contribution supplémentaire des répulsions stériques et de l'hydrophobie - interactions qui doivent également être prises en compte lors de l'analyse de l'interaction globale entre les particules colloïdales un système colloïdal.
Dans un système colloïdal, deux phases individuelles ou plus sont présentes, et la région de contact des deux phases est appelée interface lorsque le système est formé de deux liquides distincts ou d’un liquide et d’un solide, ou système formé d'un liquide et d'un gaz. Thermodynamiquement, ces systèmes sont instables, et une force motrice favorisant l'énergie du système divisera les substances non miscibles en deux phases globales distinctes. Lorsqu'une substance possède un caractère amphiphile (c'est-à-dire qu'elle possède à la fois des fractions hydrophiles et lipophiles), la substance migre et s'organise au sein de l'interphase. Ainsi, une migration a lieu tant que l'énergie sans adsorption peut neutraliser les contributions opposées de l'entropie et de l'énergie thermique. Les adsorptions de molécules à l'interface augmenteront le nombre d'interactions thermodynamiques favorables et, lorsque l'équilibre sera atteint, un nombre optimal d'interactions favorables sera formé.
L'adsorption d'un soluté tel qu'un composé amphiphile à l'interface dépend également de la concentration en solutés, car les molécules adsorbées seront en équilibre avec les molécules restant dans la masse. Cet équilibre doit être évalué d'un point de vue cinétique, car la migration des petites molécules s'effectue à des vitesses différentes de celles des grosses molécules telles que les protéines. Les petites molécules sont beaucoup plus rapides à obtenir un équilibre et peuvent donc être un paramètre important pour la formation et la stabilisation d’une interface ou d’un film superficiel. Lorsque les stabilisations proviennent de polymères tels que des protéines et / ou des polysaccharides présents dans le système, le polymère sera associé à la surface des particules colloïdales, recouvrant plus ou moins l'interface / la surface. Les gros biopolymères, tels que les protéines, présentent souvent des segments lipophiles et hydrophiles et, lorsqu’ils sont répartis dans un système multiphase, les protéines s’organisent de manière à ce que les fragments lipophiles soient en contact avec la phase huileuse, tandis que la région hydrophile sera située dans la phase aqueuse. Les fonctionnalités ioniques des polymères impliquent une répulsion entre particules de même polarité, tandis qu'une autre partie des polymères peut être dissoute dans la phase continue. Cela augmente la viscosité (en particulier le rendement) de la phase liquide, ralentissant le mouvement des particules dispersées et réduisant ainsi la possibilité de fusion des corps dispersés. À des concentrations plus élevées, les polymères peuvent également former une réticulation entre les particules, ce qui entraîne une augmentation spectaculaire de la viscosité ou de la gélification du système. D'autre part, on constate parfois que l'addition de matériau polymère déstabilise les émulsions, le mécanisme étant un polymère réticulant entre deux gouttelettes d'émulsion, qui commence la coalescence. Dans le cas de protéines présentes dans un système colloïdal, le pH du système a également un impact sur les propriétés émulsifiantes et adsorbantes des molécules (par exemple, les protéines au point isoélectrique présenteront une interaction électrostatique moins grande que les protéines à une valeur de pH où les groupes chargés sont présents et les molécules de protéines individuelles présentent une répulsion électrostatique). Les protéines ont souvent des structures quaternaires, où les parties lipophiles des protéines sont situées à l'intérieur de la structure et l'adsorption des protéines en interphase peut déplier les protéines pour obtenir un état plus énergétiquement favorable. Grace aux acides aminés hydrophiles, les fractions peuvent entrer en contact plus étroit avec la phase aqueuse. Dans le cas de protéines globulaires, la présence de protéines adsorbées sur l'interphase peut être considérée comme un réseau bidimensionnel de particules sphériques réticulées. Dans un système qui contient à la fois de grandes protéines émulsifiantes et de petites molécules amphiphiles, des adsorptions concurrentes auront lieu, mais une réorganisation des protéines a également lieu en raison de changements de conformation. Cette dernière interaction peut être considérée comme faisant partie d’un processus dynamique, allant jusqu’à l’équilibre et à l’obtention d’un système multiphase « stable ».
II-LES EMULSIFIANTS ALIMENTAIRES
Les émulsifiants alimentaires constituent un groupe important de petites molécules en relation avec la chimie physique interfaciale et de surface. Ces molécules appartiennent à un groupe de substances chimiques caractérisées par leur propriété amphiphile (c'est-à-dire que le composé présente un caractère dichotomique). Les propriétés amphiphiles sont dues à la coexistence de fonctionnalités lipophiles et hydrophiles au sein de la même molécule. Cela signifie que l'émulsifiant sera fortement polarisé et présente simultanément des affinités avec les substances polaires et non polaires. La fraction hydrophile est orientée vers les solvants polaires (généralement l’eau, ainsi que les solutés et les composés capables de former une liaison hydrogène) et, en même temps, la partie lipophile de la structure de l’émulsifiant sera attirée par un environnement non polaire (par exemple les chaînes hydrocarbonées des glycérides ou d’autres substances non polaires).
Les matières premières de base pour la production d’émulsifiants alimentaires sont les triglycérides (graisses et huiles naturelles). Ces dernières sont isolées d'un certain nombre de produits agricoles appropriés et sont ensuite transformées en une qualité raffinée, avec une très faible teneur en acides gras libres, en phospholipides et en matières colorantes sans saveur. Les graisses et les huiles sont caractéristiques de par leur origine et la composition en acides gras de l’huile est reconnue dans des limites étroites du type d’huile spécifique (par exemple huile de colza, huile de tournesol ou de palme), mais peut être modifiée par fractionnement physique ou hydrogénation pour obtenir un profil d’acides gras à intégrer dans un émulsifiant. Le choix de la source d'acide gras pour un émulsifiant est un paramètre important, car les propriétés d'interphase, etc. de l'émulsifiant peuvent être contrôlées par la longueur de la chaîne lipophile (c'est-à-dire le nombre de carbones de la fraction d'acide gras) et également par le nombre de carbone des liaisons oléofiniques présentes dans les groupes acides gras.
Les autres matières premières essentielles pour les émulsifiants alimentaires sont les polyols comme le glycérol, sorbitol et saccharose. Le glycérol et les acides gras sont produits à partir de graisses et d'huiles par hydrolyse des triglycérides et séparation successive des acides libres et du glycérol. Les deux sont purifiés en utilisant différentes techniques, par ex. décoloration, distillation ou fractionnement. Le sorbitol est dérivé des hydrolysats d'amidon. En ce qui concerne le fragment hydrophile des émulsifiants alimentaires (à savoir les polyols), les propriétés d'un émulsifiant jouent un rôle important et sont déterminées à partir du nombre de fonctionnalités hydroxyle libres et de groupes ester présents. Les autres liaisons éther présentes dans l’émulsifiant jouent un rôle important en tant que liaisons polairescontribuant à la nature des émulsifiants. Outre les matières susmentionnées, les matières premières importantes comprennent les hydroxyacides organiques tels que l'acide lactique et l'acide citrique, tous deux obtenus par des procédés de fermentation, tandis que l'acide tartrique est isolé en tant que composant naturel et sous-produit de la production de vin. Tous sont des acides qui, par estérification avec des groupes hydroxyle libres (par exemple du glycérol) peuvent modifier le degré de polarité des émulsifiants en modifiant les fragments ester, hydroxyle et carboxylique d'un émulsifiant.Le propylène glycol et l'anhydride acétique sont dérivés soit de la pétrochimie, bien que des processus de synthèse se déroulent respectivement dans le pool C-3 et le pool C-2, soit de l'industrie de la fermentation.
Les émulsifiants alimentaires sont fabriqués par des réactions entre des matières premières sélectionnées. Ces réactions sont principalement des estérifications ou des interestérifications, mais des réactions éthériques sont également courantes dans la production d'émulsifiant alimentaire. La préparation est souvent suivie de processus de purification et de séparation successifs - opérations qui créeront des esters avec la présence caractéristique de propriétés amphiphiles et respecteront la législation en matière d’identité et pureté vis-à-vis des additifs alimentaires. Les émulsifiants alimentaires peuvent être classés sur la base de leur nature fondamentale en non-ioniques, cationiques, anioniques et zwitterioniques (voir figure 1). Au sein des émulsifiants alimentaires non ioniques, les monoglycérides et et diglycérides sont les représentants les plus importants. Ce sont des substances dont la partie hydrophile est formée à partir du glycérol mono- ou diestérifié, tandis que la partie lipophile peut se voir attribuer la chaîne hydrocarbonée du radical acide gras. Comme les mono- et diglycérides possèdent des fragments hydroxyle libres, les émulsifiants sont ouverts à une estérification ultérieure.
Des dérivés non ioniques des monoglycérides sont les esters d'acide lactique des monoglycérides. L'acide lactique estérifié modifie le groupe hydrophile du monoglycéride et modifie considérablement les propriétés d'application. Les esters dérivés de monoglycérides sont également des esters d'acide acétique (c'est-à-dire qu'en plus d'une liaison ester d'acide gras, le glycérol comporte également un ou deux groupes hydroxyle acétylés). D'autres émulsifiants non ioniques comprennent les polysorbates, qui présentent un caractère plus hydrophile par rapport aux monoglycérides, en raison de la longue chaîne hydrophile de polyoxyéthylène éther liée au fragment de sorbitan (sorbitol déshydraté) estérifié en acide gras. Ces derniers (c'est-à-dire les sorbitanes estérifiés) sont des composés isolés considérés comme un type séparé d'émulsifiants non ioniques. Les polyglycérolesters sont caractérisés par le squelette hydrophile du glycérol oligomérisé, qui peut être estérifié avec un ou plusieurs acides gras, tandis que les esters de propylèneglycol tirent leur caractère hydrophile des fonctionnalités hydroxyle libre et hydroxyle estérifié. Les sucrose-esters et les sucroglycérides tirent leur nature hydrophile des groupes hydroxyle libres et estérifiés de la fraction glucidique. Dans le cas des esters de sucre ainsi que des polyglycérolesters, le degré d'estérification peut varier du mono au polyester, donnant un spectre de degrés de polarisation des émulsifiants et, par conséquent, des propriétés d'interface. Dans le groupe des émulsifiants ioniques, les émulsifiants alimentaires (du type anionique) sont principalement utilisés et, en raison de la charge sur le fragment ionique, ils présentent souvent un caractère hydrophile important. Ces émulsifiants peuvent être des dérivés estérifiés des monoglycérides, des hydroxyacides tels que les acides tartrique ou citrique étant estérifiés en un groupe hydroxyle du monoglycéride. Cependant, comme les deux acides possèdent respectivement deux ou trois groupes carboxyliques, une ou deux fonctionnalités carboxyliques libres sont présentes dans les émulsifiants obtenus et jouent donc un rôle important dans la polarité des émulsifiants.
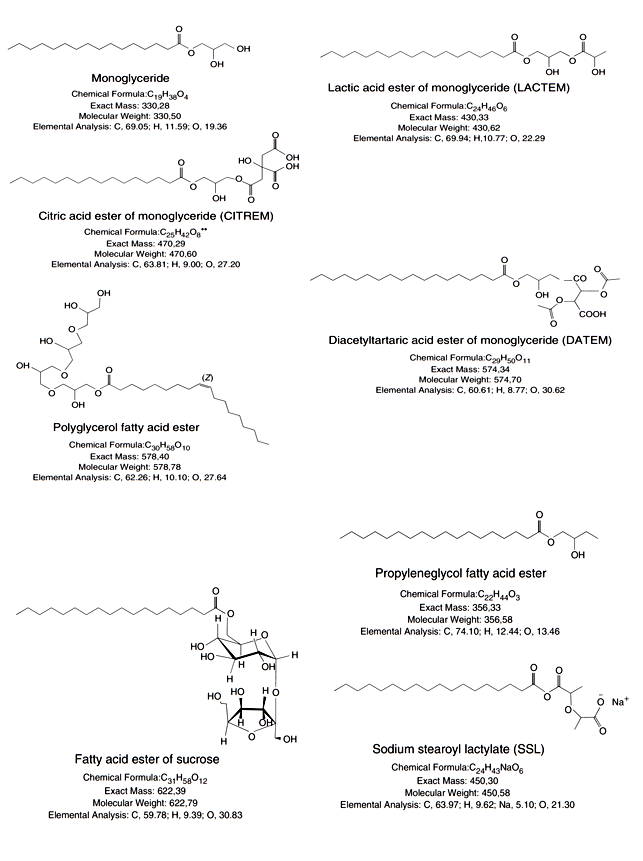
Figure 1 : Exemples d’émulsifiants
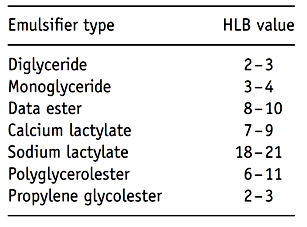
Un autre groupe d'émulsifiants alimentaires anioniques est constitué par les lactylates, qui sont un type d'émulsifiant dans lequel les acides lactiques dimérisés (oligomérisés) sont estérifiés avec un acide gras et où la fonction carboxylique libre résiduelle du groupe lactique terminal est neutralisée au sodium correspondant (SSL) ou sel de calcium (CSL). Les phosphatides d'ammonium sont dérivés de mono et diglycérides, ces derniers sont estérifiés avec un fragment phosphate pour donner un émulsifiant acide, qui est neutralisé par addition d'ammoniac. Les émulsifiants alimentaires zwitterioniques, contenant à la fois une fraction anionique et une fraction cationique, ne peuvent être trouvés que dans un ou plusieurs matériaux de la lécithine, sous-produit de l’industrie des graisses et des huiles, composée de plusieurs phospholipides différents. Une autre façon de classer les émulsifiants alimentaires consiste à utiliser le l’indice HLB pour l'émulsifiant. L’indice HLB est une figure numérique représentant certaines informations concernant les propriétés fondamentales de la substance (par exemple, son action dans l’eau) et une fonctionnalité simplifiée en caractérisant l’équilibre entre les propriétés hydrophiles et lipophiles de l’émulsifiant. Ainsi, un faible indice de HLB indique une molécule avec un degré élevé de caractère hydrophobe, tandis qu'une valeur élevée exprime une structure avec une forte nature hydrophile. Cet indice peut être déterminé expérimentalement, mais il est principalement calculé à l'aide de l'estimation de Davies ou à partir de tableaux rapportés dans la littérature répertoriant les valeurs HLB d'un certain nombre de substances pures et commerciales. Le tableau 2 énumère quelques valeurs d'émulsifiants alimentaires.
Les chaînes d'hydrocarbures lipophiles des groupes d'acides gras, dues aux forces répulsives vis-à-vis de l'eau, vont s'organiser pour minimiser les contraintes et l'énergie du système. Il a été démontré que les différentes mésophases liées à la température ont été en fonction de la concentration dans les systèmes aqueux. Il a également été démontré que la nature de la chaîne d’acides gras joue un rôle crucial et, par exemple, les diagrammes des monoglycérides palmétiques / stéariques et du glycérol-oléate insaturé sont significativement différents. Le processus se fait en deux étapes à partir de l'état gel monoglycéride-eau, dans lequel l'émulsifiant forme des plaques ou des feuilles lamellaires séparées de couches aqueuses connues sous le nom de gel alpha.La formation du coagel suit un mécanisme en deux étapes, avec une discrimination entre les isomères L et D dans une étape à taux déterminé et organisée en deux dimensions. Au cours de la deuxième étape suivante, la croissance prend place dans la troisième dimension.
Les éniomères d'émulsifiants et de lipides en général doivent être considérés comme des stéréoisomères différents, et leurs mélanges auront une influence fondamentale sur le tassement moléculaire et la cristallisation. Les mélanges de stéréoisomères peuvent se cristalliser sous forme de conglomérats de formes différentes ou constituer des composés racémiques où, par exemple, le point de fusion sera lié au rapport entre les deux isomères opposés. Il peut également s'agir de mélanges pseudo-racémiques, avec un point de fusion indépendant du rapport - circonstances qui rendent la cristallisation des lipides très complexe. D'autres types d'émulsifiants alimentaires dans les systèmes aqueux vont également former des mésophases, mais ils ne se révèlent généralement pas aussi complexes que dans le cas des monoglycérides. La nature des émulsifiants alimentaires, pour former des phases cristallines liquides, a été reconnue comme un paramètre fondamental pouvant être utilisé pour former et / ou préserver les textures des aliments. Lorsque des émulsifiants sont ajoutés à une huile (c'est-à-dire un triglycéride), la nature dichotomique des molécules d'émulsifiant sera un facteur majeur, car la partie hydrophile de l'émulsifiant s'associera en raison de la présence de forces relativement fortes telles que des dipôles ou, dans de nombreux cas en raison de la liaison hydrogène. Cela crée une interaction intermoléculaire relativement forte entre les fractions hydrophiles des émulsifiants, tandis que la chaîne acyle de l'émulsifiant aura une affinité pour les chaînes acyle voisines des triglycérides environnants et minimisera ainsi l'énergie du système. C'est le contexte du rapport de Chen & Terentjev où des structures associatives ont été observées lorsque des émulsifiants étaient présents dans les triglycérides (par exemple les monoglycérides dans l'huile). Au-dessus du point de fusion, les monoglycérides d’une huile forment un fluide isotrope et lorsque la température diminue en dessous du point de Krafft, des phases laminaires inverses se forment et s’organisent en hexagone.
Tableau 2 : Indexe HLB de quelques émulsifiants
Au fil des ans, un certain nombre d'études et de brevets ont traité les émulsifiants des triglycérides en tant que composant structurant des graisses ou en tant qu'alternative possible aux triglycérides partiellement hydrogénés contenant des acides gras trans, en raison de leur capacité à s'organiser en structures et de cette manière, présentent des propriétés plus ou moins comparables aux triglycérides hydrogénés utilisés dans des formules alimentaires telles que les margarines, etc. En fonction de l'hydrophilie d'une substance active à l'interface, l'émulsifiant peut-être plus ou moins miscible avec les triglycérides liquides. Dans le cas de corps gras solides (triglycérides cristallisés) et d'une solubilité limitée de l'émulsifiant, ce dernier peut être plus ou moins intégré dans un réseau cristallin de triglycérides. La compatibilité limitée de l'émulsifiant peut apparaître sous forme d'imperfections dans les cristaux, alors que des émulsifiants plus hydrophiles vont se nucléer en raison de forces répulsives dans le processus et se présenteront donc sous forme de germes d'hétéro-nucléus isolés lors des premières étapes d'une cristallisation progressive des triglycérides. Pendant la phase de croissance des cristaux lipidiques, l'émulsifiant peut-être adsorbé à la surface des cristaux et ainsi protéger les triglycérides liquides, empêchant ainsi le développement ultérieur de la croissance cristalline. Outre son influence sur le taux de croissance, l'adsorption sur la surface solide d'un cristal peut également avoir un impact important sur la nature polymorphe de la graisse. L'émulsifiant peut former une barrière qui retardera ou inhibera non seulement l'échange avec les triglycérides en solution, mais également les échanges solide-solide et, de cette manière, réduira le taux de transformations polymorphes entre les différentes formes cristallines. L'interaction d'un émulsifiant avec des triglycérides en cours de solidification peut donc modifier ou empêcher la cristallisation, et les émulsifiants trouveraient une application en tant qu'agents anticristallisants ou anti-opacifiants dans les huiles végétales. Dans d'autres cas, la présence d'un émulsifiant peut-être un accélérateur et un stabilisant dans un processus de cristallisation. Un cas contraire peut également se produire avec certains types d'émulsifiants, l'émulsifiant pouvant agir de manière synergique en frittant des cristaux de graisse et ainsi augmenter le volume de sédiment solide de triglycérides. Dans ce dernier cas, on pense que l'émulsifiant (à savoir le monooléate de glycérol) s'adsorbe sur la surface du cristal et améliore le frittage du cristal. Une explication possible est que les émulsifiants sont adsorbés sur des cristaux de triglycérides de telle sorte que les groupes non polaires soient incorporés dans le cristal et le fragment hydrophile dans le triglycéride liquide. L’hydrophilie provoque une interaction avec des groupes hydrophiles similaires au niveau des cristaux voisins par les forces dipolaires et la liaison hydrogène, qui lie les triglycérides en un réseau, ressenti comme une augmentation de la graisse solide. De plus, l'adsorption d'émulsifiants dans le cristal de triglycérides aura un effet stabilisant car l'émulsifiant retardera la maturation d'Ostwald vue que les vitesses de désintégration et de croissance sont réduites par la présence d'un film d'émulsifiant sur les cristaux. Les systèmes à deux phases liquides principales différentes sont appelés émulsions. Dans ces systèmes, l'huile, sous forme de triglycérides et d'eau, est présentesoit sous forme de gouttelettes soit sous forme de liquide environnant, en fonction de la phase concernée. La phase environnante est appelée phase continue et les émulsions sont décrites comme des émulsions "huile dans l’eau" ou "eau dans l’huile". Les phases séparées peuvent, sous forme simple, comprendre de l’eau pure et de simples triglycérides liquides. Toutefois, dans le cas des aliments, les systèmes sont beaucoup plus complexes car il y aura des solutés, ainsi que des substances non solubles telles que des protéines, du sel et des glucides, présentes dans la partie aqueuse. Dans la phase lipophile, les triglycérides peuvent être présents sous forme liquide mais aussi sous forme de cristaux adipeux, associés à une gamme de substances organiques non polaires différentes. L’interphase de l’eau et de l’huile est formée de matériaux tels que des protéines et des émulsifiants, ainsi que de phospholipides. Mais également des matériaux solides tels que des cristaux lipidiques et des sels non solubles peuvent agir sous la forme d’une stabilisation et participer ainsi de l'interface. Les composants les plus importants de l'interface sont les protéines et les émulsifiants de molécules de petite taille. Les deux types ont une affinité significative pour les phases polaires et non polaires. À la frontière, un équilibre entre les protéines et les émulsifiants a lieu car les émulsifiants alimentaires sont en concurrence et déplacent les protéines. De plus, certains types d'émulsifiants peuvent présenter une affinité pour les protéines et ainsi se lier à celles-ci par des liaisons hydrogène ou des forces dipolaires - une association qui implique des modifications des propriétés des protéines. Cela signifie que l'interphase sera formée de protéines et d'émulsifiants à petites molécules. L'interface ne représente pas un mélange uniforme des deux types de matériaux, mais il y a à l'interface des zones formées de protéines, séparées par d'autres zones composées d'émulsifiants. La formation a été décrite comme un mécanisme orogénique dans laquelle un film de protéine est initialement formé à l'interface et successivement des émulsifiants à petites molécules pénètrent dans le réseau protéique à des endroits imparfaits. Au fur et à mesure que les émulsifiants s'accumulent, les protéines subissent un stress croissant jusqu'à ce qu'un déplacement se produise à partir de l'interface. Une conséquence de l'extrusion des protéines par des émulsifiants alimentaires est un affaiblissement du film d'interface, avec pour résultat des propriétés de barrière plus élastiques. Le mécanisme orogénique repose sur des études effectuées sur des émulsifiants très hydrophiles présents dans la phase aqueuse. Il décrit le processus comme de petites molécules d'émulsifiant singulières commençant à pénétrer dans la protéine puis à s'accumuler. Cependant, la plupart des émulsifiants alimentaires ont une affinité pour la phase aqueuse ainsi que pour la phase lipophile et ils seront présents dans les deux phases. En outre, les émulsifiants s'organiseront en mésophases et il est fort probable que l'émulsifiant sera présent sous forme de petits corps lyotropes dans les phases respectives. Ces structures exposent une feuille hydrophile, composée de multiples fractions hydrophiles de l'émulsifiant et qui amplifient la force ou le potentiel hydrophile. Elles représentent donc une force beaucoup plus forte dans le remplacement des protéines de haut poids moléculaire liées par affinité à l'interface, comme illustré à la figure 2. La présence de cristaux liquides à l'interface peut également agir sur la cristallisation des triglycérides en agissant comme un noyau et en favorisant la formation de cristaux de triglycérides à l'interface.La cristallisation lyotrope des émulsifiants alimentaires est un paramètre important à l'interface des émulsions alimentaires. Dans le cas de systèmes eau dans l’huile, le réseau de cristaux lipidiques et les émulsifiants alimentaires jouent un rôle important dans la stabilisation de l'émulsion car les cristaux d'émulsifiant seront à l'interface et sous forme de stabilisation du système par Pickering. Les autres systèmes qui présentent un grand intérêt pour les aliments sont les mousses, dans lesquelles un gaz est enfermé dans un liquide, ce qui peut inclure des matières en suspension ainsi qu'une ou plusieurs phases liquides et peut donc être complexe.
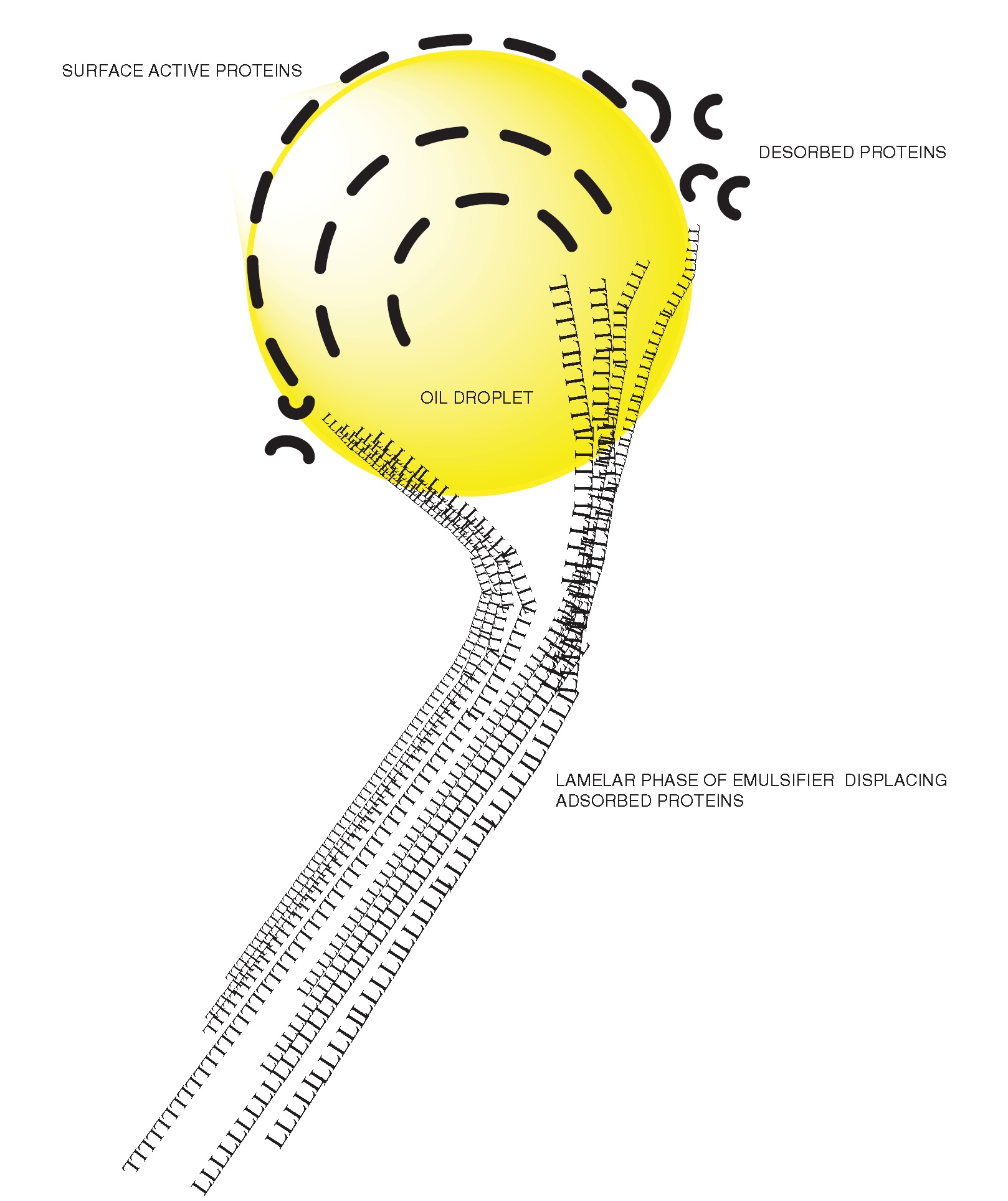
Figure 2 : Déplacement d'émulsifiant de faible poids moléculaire (L) d'une protéine à l'interphase d'une gouttelette d'huile.
Les mousses sont souvent des émulsions aérées, comme dans le cas des crèmes de lait fouettées et des pâtes à gâteau fouettées, etc. Dans une mousse, les cellules de l'air sont séparées les unes des autres par un film liquide. En fonction de l'épaisseur du film, les systèmes peuvent être considérés comme une dispersion d'air dans un liquide dans les cas où l'épaisseur du film est supérieure ou de la même taille que les cellules à air, où le film est mince. Sous une contrainte faible, la mousse agit comme un solide mais, au-delà d'une certaine contrainte un écoulement est obtenu. La phase liquide formant la barrière entre les cellules à air (c'est-à-dire les lamelles) comprend la surface qui assure la stabilité de la mousse à la coalescence. Ainsi, l'interface est constituée de composés amphiphiles tels que des protéines et des émulsifiants alimentaires, mais dans de nombreux cas, elle comprend également des matériaux solides tels que des cristaux de graisse, etc. Le système aéré n'est pas stable car la rupture de la barrière exposée peut conduire à la coalescence, aboutissant à un effondrement de la mousse. L'instabilité due au drainage du film doit également être prise en compte, car le drainage peut conduire à un point où l'épaisseur de la barrière devient si petite que des fluctuations thermiques peuvent faire éclater les lamelles. La stabilisation de la mousse est une combinaison de plusieurs mécanismes différents et dépend de la nature des composés présents dans le système. On a souvent constaté que les protéines interactives, avec ou sans émulsifiants alimentaires, jouent un rôle important dans la formation et la stabilisation d'une mousse. Comme dans le cas des émulsions, il y a une compétition entre les protéines et les émulsifiants alimentaires adsorbés sur le film de surface. Les protéines se déplient et forment un réseau à la surface, tandis que les émulsifiants migrent vers la surface en des points non recouverts et, par adsorption successive, développent et déplacent les protéines jusqu'à ce que l'hétérogénéité du filament protéique quitte la protéine en points isolés. Un procédé suivant le principe orogénique, tel que le cas d’une interface liquide-liquide, trouve également son origine dans des émulsifiants très hydrophiles tels que les polysorbates, tandis que des émulsifiants comme des monoglycérides, qui forment des mésophases composées de nombreuses molécules en milieu aqueux, sont pris dans le modèle. Dans une étude sur les monoglycérides et les protéines à une interface eau-air, le déplacement des protéines est plus facile à étaler que les films adsorbés et quand ces derniers ont un degré de ségrégation plus élevé, etc., alors que l'on observe l'inverse à une concentration plus élevée de l'émulsifiant. Ceci, combiné au fait que ce type de monoglycérides a des comportements de mésophase assez différents dans les systèmes aqueux, suggère que la nature lyotropique des émulsifiants alimentaires en régime aqueux a un impact important sur le film de protéine émulsifiante. On a constaté que l’effet de l’addition d’émulsifiants alimentaires sur un fouet entraînait un rapport liquide plus élevé, la mousse étant plus dense en raison de la taille généralement plus petite des cellules à air. Les propriétés de cisaillement de surface sont aussi importantes pour la stabilité de la mousse, car une concentration plus élevée d'émulsifiants à l'interface augmente la viscosité du film, ce qui implique une stabilité accrue.
Un autre aspect des émulsifiants à l'interface air-eau concerne les systèmes moussés sans protéines. Dans ce type de système, le comportement en mésophase des émulsifiants alimentaires est reconnu par la capacité et La stabilité d'une mousse aqueuse formée en présence d'un polyglycérolester. On a constaté que la capacité de la mousse augmentait de manière exponentielle avec la teneur en émulsifiant. La stabilité exige un certain niveau avant que la durée de vie ne devienne stable. De plus, il a été trouvé que des émulsifiants insaturés, ou mélangés avec des fractions d’acides gras insaturés rendent la mousse plus labile. La stabilité de la mousse a été attribuée à de petites particules formées à partir de l'émulsifiant dans une sorte de stabilisation de Pickering, alors que les mésophases laminaires du polyglycérol semblent jouer un rôle mineur. Un émulsifiant comme l’ester de polycérol forme un film monomoléculaire à l'interface air-eau, associé à un nombre de bicouches dans la masse de la surface. Les émulsifiants tels que les monoglycérides sont adsorbés à la surface par les cristaux liquides laminaires de la phase de masse et une partie des structures lamellaires peut atteindre la surface dans la masse aqueuse, stabilisant ainsi la mousse, comme illustré à la figure 2, où l'huile est remplacée par l’air. Les propriétés mécaniques du film sont attribuées à l’interaction des fractions alkyles de l’émulsifiant qui, à l’état solide, rend le film moins flexible. Dans une étude utilisant la microscopie à balayage de force sur une mousse de polyglycérol, la présence d'une monocouche combinée à des vésicules d'émulsifiant formant plusieurs couches dans la phase en masse, formation de contrainte dans la phase aqueuse, a été confirmée. Passant d'études portant sur des systèmes modèles relativement simples à des systèmes alimentaires complexes, comprenant de nombreux ingrédients d'origine soluble et non soluble, tels que les gâteaux éponges, un déplacementdes protéines de l'œuf et de la farinea été démontré. Le déplacement affaiblit la résistance du film superficiel entre le sérum et le gaz de la pâte et rend ainsi le film plus flexible et la cellule à gaz plus facile à dissocier en plusieurs cellules plus petites (à savoir un système plus stable). En outre, les émulsifiants alimentaires forment des mésophases avec l'eau et forment des structures en forme de réseau qui augmentent la viscosité de la pâte et empêchent ainsi le mouvement et la coalescence des bulles de gaz lors du traitement et de la cuisson de la pâte.
Dans les gâteaux à forte teneur en matières grasses, la pâte fouettée est formée à partir des protéines présentes dans une « pâte tout en un ». Le film protéique n’est intermédiaire que sous forme d'interaction entre la graisse sous forme de petits globules ou plutôt de cristaux de triglycérides dont l'extrémité est fixée à la phase gazeuse. Les cristaux de graisse - ou plus précisément les extrémités des cristaux - sont adsorbés à l'interface gaz sérum, stabilisant la mousse, qui considère également que les émulsifiants alimentaires font partie du film formé. Dans ce cas, les émulsifiants moléculaires de petite taille se complexent et interagissent avec les particules grasses, et il est très probable que les fragments hydrophiles d'un émulsifiant, liés par le fragment lipophile à un cristal ou globule gras, puissent créer des liaisons hydrogène avec des groupes similaires reliés aux particules grasses voisines et forment ainsi des conglomérats ou des réseaux comprenant des solides de confinement ainsi que des cellules à gaz.
Les articles qui suivent seront accès sur les émulsifiants alimentaires les plus utilisés par l’industrie agroalimentaire en détails.
















