I-INTRODUCTION
Les conservateurs sont des composés utilisés dans le but de retarder ou prévenir la détérioration chimique et microbiologique des aliments. Les nitrites et les nitrates (figure 1) sont utilisés dans de nombreux aliments en tant que conservateurs et ingrédients fonctionnels. Les nitrites sont des composés essentiels utilisés pour les produits carnés. Ils sont aussi connus pour être des additifs alimentaires multifonctionnels, entre autre ils sont considérés comme antioxydants puissants. Les nitrites sont des cristaux hygroscopiques de couleur blanche à jaune pâle. Le nitrite de sodium (NaNO2) (E 250) est nettement moins hygroscopique que le nitrite de potassium (KNO2) (E 249). Les nitrites sont assez solubles dans l'eau et l'ammoniac liquide, mais beaucoup moins dans l'alcool et les autres solvants. À température ambiante, une unité d'eau dissout une unité de nitrite de sodium ou trois unités de nitrite de potassium.
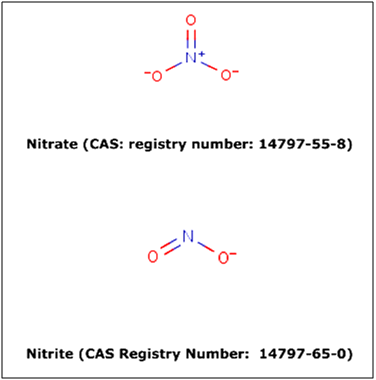
Figure 1 : Structure des nitrites et nitrates
II-ASPECTS ANTIMICROBIENS
Le nitrite de sodium joue un rôle important dans l'inhibition de la croissance de Clostridium botulinumet de la production de toxines chez les produits séchés / maturés. Habituellement, des concentrations d'entrée qui sont supérieures à 100 mg / kg sont utilisées afin d’avoir un effet antimicrobien. Une concentration de 200 mg / kg à pH 6,0 est capable d'inhiber les souches des espèces Achromobacter, Aerobacter, Escherichia, Flavobacterium, Micrococcus et Pseudomonas. Les salmonelles, les lactobacilles et C. perfringens sont plus résistants que d'autres especes du type Clostridia. Le temps nécessaire pour qu’une viande salée en conserve subisse un effet de gonflement est de 6,7, 29,8, 82,6 et 94,3 jours, lorsque 0, 50, 100 et 156 µg / g de nitrite de sodium sont ajoutés. L'effet principal du nitrite est apparu au cours de la détermination de la longueur de la phase de latence. Une fois que le gonflement des boites de conserve a commencé, le taux de gonflement ne diffère pas de façon significative à 50, 100 et 156 µg / g de nitrite de sodium. À 50 µg / g de nitrite, une probabilité de toxicité de 75% est prévue après 3 mois. Le degré de sécurité associé à la production de toxinesde C. botulinum peut varier en fonction de la composition de la formulation et les fortes réductions des concentrations des nitrites dans les produits pourraient avoir des conséquences graves.
La germination et la prolifération des spores bactériennes comprennent cinq étapes successives: (i) la germination, (ii) le gonflement de la spore germée, (iii) l’émergence d’une nouvelle cellule végétative, (iv) l’élongation, et (v) la division cellulaire. L'effet inhibiteur des nitrites sur les générateurs de spores bactériennes est apparemment dû à l'inhibition de la croissance et de la division cellulaire. Il y a trois points d'inhibition dans le processus de croissance des spores anaérobies: (i) jusqu'à 0,06% à pH 6,0 ou entre 0,8% et 1% à pH 7,0, le nitrite permet l'émergence et l'élongation de cellules végétatives mais bloque la division cellulaire, les cellules allongées se sont lysées laissant les couches de spores vides; (ii) avec plus de 0,06% de nitrite à pH 6,0 ou plus de 0,8% à 1% à pH 7,0, les spores perdent leur réfractilité et gonflent, mais la cellule végétative n’émerge pas; et (iii) même jusqu'à 4% de nitrite n’empêchent pas la germination (perte totale de la réfractilité) et le gonflement des spores. Le nitrite de sodium induit la germination des spores de C. sporogenes et ce processus s’accélère en utilisant des concentrations accrues de nitrite de sodium, un pH bas et une température d'incubation élevée. L'augmentation du taux de germination avec l'augmentation de la température et de la concentration en nitrites peut être un reflet de l'altération de la structure tertiaire d'une protéine de spore, qui peut à son tour être impliquée dans le complexe calcium-acide dipicolinique. L'effet stimulant des nitrites sur la germination joue un double rôle dans la préservation: (i) induction de la germination des spores, ce qui les rend susceptibles d'un réchauffement et (ii) inhibition de la croissance des spores survivantes. Les concentrations plus faibles inhibent la croissance de la spore après sa germination, tandis que les concentrations plus élevées de nitrites inhibent la germination elle-même. Les nitrites exercent un effet antimicrobien dépendant de la concentration sur l'excroissance des spores de C. botulinum et d'autres Clostridia. L'efficacité des nitrites dépend de plusieurs facteurs environnementaux dans une situation très complexe, telle que celle des aliments. Ainsi, la concentration de nitrite requise pour éviter la croissance dépend du type de support ou d’aliments et des conditions environnementales.
III-FACTEURS INFLUANT SUR L'EFFICACITE DES NITRITES
1-Effets du pH
Les nitrites se révèlent être les plus inhibiteurs pour les bactéries à un pH acide. En effet, l'acidification augmente considérablement l'action conservatrice du nitrite chez le poisson. En milieu bactériologique, l'action inhibitrice augmente avec la diminution du pH, en particulier à des pH inferieurs ou égales à 6,0. Dans ce cas, le mode de conservation peut être dû à la formation d'acide nitreux actif. L’action significative de la conservation à pH bas est due à l'acide nitreux, inhibiteur actif non dissocié. L'effet inhibiteur du nitrite sur C. botulinumest multiplié par 10 lorsque le pH est réduit de 7,0 à 6,0. D’autres bactéries subissent des inhibitions similaires de 10 fois pour une diminution unitaire du pH comme dans le cas deStaphylococcus aureus, Bacillus et C. sporogenes.
L’effet du pH acide sur l'inhibition bactérienne induite par les nitrites reflète également la conversion de nitrites en acide nitreux. Le « cycle des nitrites » incluant la dynamique de la production d'acide nitreux peut être visualisée comme étant une réaction cyclique au cours de laquelle les nitrites subissent une réaction d'oxydoréduction concomitante, ce qui entraîne la formation de nitrates, d'oxyde nitrique et de dioxyde d'azote (figure 2). Le dioxyde d’azote, réagissant avec l’eau, produirait plus de nitrate et de nitrite. À un faible pH (pH 3–4), le cycle forme rapidement du NO3 et du NO. À des pH intermédiaires (pH 4,5–5,5), le cycle tourne plus lentement. La présence de HNO2 est prolongée, ce qui augmente son potentiel de réaction. C'est le niveau d'activité bactéricide maximum. À des pH plus élevés (pH 6–7), l'équilibre se déplace vers NaNO2, le cycle cesse de fonctionner et aucun effet bactéricide n'est observé. L'acide nitreux et l'oxyde nitrique ont deux domaines de réaction fondamentaux: (i) avec la cellule bactérienne elle-même et (ii) avec divers constituants du milieu les rendant indisponibles pour un métabolisme ultérieur. L'une ou l'autre de ces réactions, ou les deux, pourrait entraîner une bactériostase. Tous les nitrites mesurables dans divers produits séchés / maturés peuvent être volatilisés sous vide poussé. Cela indique que dans la matrice carnée, le nitrite est converti en oxyde nitrique et peut produire un équilibre complexe avec d'autres composants. À 20 ° C, la croissance de C. perfringensin vitroest inhibée par 200 µg / mL de nitrite et 3% de sel ou 50 µg / mL de nitrite et 4% de sel à pH 6,2. Alors que les streptocoques fécaux présentent une croissance in vitroà 400 μg / mL et 6% de sel. Dans le cas de la Salmonelle, cette dernièreprésente une croissance visible en 1 semaine à 20 ° C en présence de 400 µg / mL de nitrite et de 4% de sel. Une inhibition significative par le sel et le nitrite n’est obtenue qu’à des températures inférieures (10 ° C ou 15 ° C) et à un pH de 5,6 ou 6,2. Escherichia coli est cependant plus résistante que Salmonella. Son inhibition ne se présente qu'aux valeurs extrêmes de pH (5,6), de sel (6%), et de nitrite (400 µg / mL) à une la température de 10 ° C. La survie de Listeria monocytogenesest détectée après fermentation et séchage, bien que le nombre des colonies de cette bactérieest généralement réduit. Des enquêtes sur les produits carnés fermentés ont confirmé la présence de Listeria monocytogenes dans les produits finis. L'ajout de nitrites et de nitrates à un produit à base de viande à des niveaux officiellement approuvés ne provoquent pas l'élimination de Listeria monocytogenes. L'acidité et le nitrite augmentent le taux d'inactivation de Listeria monocytogenes. Le nitrite (0–300 µg / mL) et le pH produisent un important effet chez les poissons non cuits et les produits carnés fermentés. En effet, le temps nécessaire pour obtenir un déclin de 4 log est majoritairement influencé par le pH, allant de 21 jours à pH 5,0 à moins de 1,0 jour à pH 4,0. Les ajouts de nitrite n’ont pas d’effet sur la survie, ce qui suggère que la concentration efficace correspond au niveau de nitrite résiduel en diminution rapide. Cependant il existe un potentiel de production de bactériocines des bactéries lactiques dans le cas de la viande fermentée.
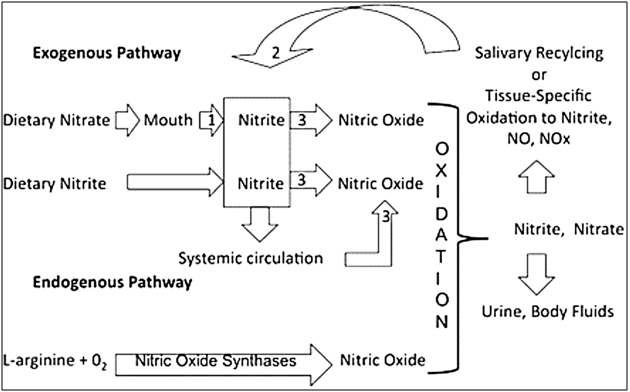
Figure 2 : Diagramme schématique de la disposition physiologique des nitrates, des nitrites et de l'oxyde nitrique de sources exogènes (alimentaires) et endogènes.
2-Effets de l'oxygène
Les nitrites présentent un effet plus inhibiteuren conditions anaérobies. En effet, en aérobiose, Staphylococcus aureus se développemieux en présence de concentrations significativement plus élevées de nitrite de sodium qu’en absence d’oxygène. D’autre part, il est à noter que l'ampleur de l'inhibition dépend de l'interaction de la concentration en nitrite de sodium, du pH initial et de la pression partielle de l'oxygène. Après la baisse initiale du pH, les cultures aérobies induisent une augmentation du de ce dernier qui estsupérieur à celle du pH initial. Tandis que les cultures anaérobies maintiennentle pH à un niveauminimal. Les lésions et la destruction des cellules sont plus apparentes à un pH inférieur en présence d'une concentration de nitrites d'environ 500 ppm. Cependant, l’ajout de 200 ppm de nitrite de sodium aux viandes séchées offre une protection significative contre la croissance de Staphylococcus aureus, en particulier si le produit carné est emballé sous vide. Le nitrite peut aussi inhiber la croissance de Staphylococcus aureus en bloquant les sites sulfhydryle de la coenzyme A ou de l'acide ß-lipoïque, bloquant ainsi le métabolisme normal du pyruvate.
3-Effets d'autres composants alimentaires
La température, la concentration en sel et la taille initiale de la colonie ont également une influence significative sur le rôle antimicrobien du nitrite. Le chlorure de sodium seul à des concentrations de 9,0% à 10,5% peut inhiber la croissance et la production de toxines par C. botulinum. L’ajout du nitrite à des concentrations de 75 et 150 ppm doit être accompagner de taux respectifs de chlorure de sodium de 5,8% et 4,9% nécessaires pour inhiber la formation de toxine. Les teneurs en sel habituelles ajoutées à la viande séchée vont de 2% à 3% du poids du produit. Cela indique que le sel seul n'est pas toujours un inhibiteur effectif de la croissance et de la formation de toxinespar C. botulinum. Les spores de bactéries dans une matrice carnée en conserve se trouvent aussi bien significativement inhibées par des interactions de chlorure de sodium avec du nitrite ou du nitrate de sodium (E 251) ainsi que des interactions de pH avec du chlorure de sodium ou des trois variables de façon simultanée. La plupart des souches de C. botulinum de type A et protéolytiques de type B et F se développent en présence de 150 à 200 mg / kg de nitrite de sodium ou de chlorure de sodium à 6% à pH 6,0. Cependant, dans les mêmes conditions, 200 mg / kg de nitrite de sodium plus 3% de chlorure de sodium inhibent presque toutes les souches. Ces résultats indiquent qu'une combinaison de sel, de nitrite et de pH peut être synergique pour l'inhibition. Les facteurs suivants ont un effet inhibiteur combiné sur la croissance de C. botulinum: chlorure de sodium (0% –4,5% p / v dans l'eau), nitrite de sodium (100–300 µg / g), nitrate de sodium (0–500 µg / g), isoascorbate de sodium (0–1 000 µg / g), polyphosphate (0% –0,3% p / v), traitement thermique (70–80 ° C) et température de stockage (15– 35 ° C). Le traitement au nitrite, au sel ou au traitement thermique combiné avec l'isoascorbate, lepolyphosphate ou le nitrate avec une température de stockage adéquate a considérablement, réduit considérablement la production de toxine. L’effet relatif de l’augmentation de la teneur en nitrites devient moins important en présence d’isoascorbate ou de fortes concentrations de sel. L'ajout de polyphosphate renforce l’effet de l’isoascorbate. Les combinaisons de faible teneur en nitrite (40 µg / g) et de sorbate / acide sorbiquepermettent de contrôler la croissance de C. botulinum aussi efficacement que le taux de 156 µg / g de nitrite seul. Le faible niveau de nitrite (40 µg / g) seul n’a pas d’effet significatif sur la croissance de C. botulinum, mais garanti une couleur et un goût durcis acceptables. Les facteurs qui réduisent la production de toxines de C. botulinumsont (i) le sorbate de potassium, (ii) l’augmentation du chlorure de sodium, (iii) la diminution du pH et (iv) la diminution de la température de stockage.
L'acétate d'éthylènediaminetétraacétique (EDTA), l'isoascorbate et l'ascorbate renforcent l'efficacité antibotulinale du nitrite dans la viande en conserve. Le degré d'inhibition est inversement proportionnel au taux de fer et directement lié au taux d'EDTA. L'utilisation d'isoascorbate et d'ascorbate a des attributs à la fois positifs et négatifs selon leur niveau chez les produits carnés. À un niveau modéré, l'effet synergique est dû à la cause séquestrante de l'isoascorbate ou de l'ascorbate sur un cation, le fer. D'autre part, les niveaux excessifs d'ascorbate diminuent son efficacité, car l'isoascorbate et l'ascorbate provoquaient une diminution plus rapide du nitrite résiduel. L'EDTA séquestre plus efficacement le fer, le rendant ainsi moins disponible pour prévenir l'inhibition des nitrites. L’utilisationd’une quantité minimum d'isoascorbate pour accélérer la réaction de durcissement et stabiliser la couleur et le goût, et l’ajout d’une faible quantité d'EDTA améliorent la protection botuline. Les conditions optimales de l’inhibition de la croissance de Bacillus cereus dans des saucisses crues incluent l’ajout de 500 mg / kg d'isoascorbate de sodium et de 200 mg / kg de nitrite de sodium. L'isoascorbate de sodium seul n'a aucun effet inhibiteur.
4-Effets du traitement thermique
En milieu bactériologique, l’effet inhibiteur des nitrites est décuplé après chauffage suite à la formation d’une substance extrêmement inhibitrice (inhibiteur de Perigo). Une quantité faible que 3–5 ppm de nitrite de sodium chauffée pendant 20 min à 105–115 ° C peut inhiber la croissance de C. sporogenes et cette inhibition dépend légèrement du pH du milieu. La vitesse à laquelle cette substance inconnue est produite est maximale à une température d'environ 110 ° C. À des températures supérieures à 110 ° C, la substance inconnue se décompose ou réagit de telle sorte que son activité inhibitrice diminue. Un effet similaire est enregistré chez 30 souches de Clostridium, dont C. botulinum de types A, B, E et F (14 souches) et C. welchii (8 souches). Un agent réducteur tel que le thioglycolate, l'ascorbate ou la cystéine et l'hydrolysat de protéines sont des composants nécessaires pour produire cet effet. L'inhibition estplus forte dans le cas de 9 souches de Bacillus(14 souches). Streptococcus durans (faecium) est également sensible à cet effet, alors que Streptococcus faecalis et Salmonellasont plus résistantes. Cette substance ou ces substances inhibitrices contiennent des substances telles que le sel noir de Roussin (thionitrosyle de fer) et les nitrosothiols. Des groupes sulfhydryle ainsi que d'un groupe nitrosofont aussi partie de la composition de cette inhibition. Les inhibiteurs dérivés des nitrites agissent pratiquement à tous les stades du cycle de vie de Bacillus, ce qui suggère que leur mode d'action est plutôt général et que l'inhibition peut résulter de l'inactivation de plusieurs systèmes ou étapes métaboliques sensibles.
Un inhibiteur de C. perfringensse forme lorsque de faibles concentrations de nitrites sontautoclavées avec un milieu chimique défini. Seuls les acides aminés et les sels minéraux sont impliqués dans la production de cet inhibiteur. Le composé toxique se forme à un niveau sublétal à partir de la cystéine, du sulfate ferreux et du nitrite de sodium. Autres composés qui font partie de cette inhibition sont la S-nitrosocystéine, le sel rouge Roussin instable et un complexe de cystéine, de fer et d'oxyde nitrique. L'inhibition observée pourrait être due aux effets combinés des concentrations sublétales de chaque composé. Un traitement thermique prolongé de la viande provoque la décomposition des protéines avec libération d'acides aminés, de peptides et éventuellement d'amines. Les nitrites réagissent avec les amines et les acides aminés pour former des composés N-nitroso, soit des N-nitrosamines, soit des N-nitrosamides, qui sont toxiques et cancérogènes pour les animaux et mutagènes pour diverses espèces de micro-organismes. L'effet inhibiteur du nitrite peut être augmenté en ajoutant des agents réducteurs tels que la cystéine, le thioglycolate et l'ascorbate. Ces agents sont connus pour contribuer à la réduction des nitrites et peuvent affecter la formation de réducteurs nitroso. Ces véhicules intermédiaires peuvent transférer le groupe nitroso directement aux composants des cellules bactériennes ou libérer de l'oxyde nitrique. L'ajout d'agents réducteurs aux suspensions de viande diminuele potentiel rédox et augmente l'activité inhibitrice. L’inclusion d'ascorbate de sodium, de cystéine (base libre) et de thioglycolate augmente l'effet inhibiteur du nitrite, mais l’inclusion du formaldéhyde sulfoxylate de sodium et du formaldéhyde bisulfite de sodium induit à une diminution marquée de l'activité inhibitrice. La lactoferrine (une glycoprotéine liant le fer) et la transferrine réagissent avec le nitrite comme inhibiteur efficace pour la croissance des spores de Bacillus cereus. L’inhibiteur se forme à 105 ° C ou plus, ce qui dépasse les températures normalement utilisées dans le traitement de la charcuterie. L’inhibiteur de Perigo est formé dans un milieu de culture uniquement lorsque des groupes sulfhydryle et du fer sont présents. Les nitrites réagissent avec divers composants chimiques naturels dans le système complexe de la viande. Les conditions de chauffage normalement utilisées dans le processus de durcissement accélèrent ces réactions et à la fin du processus, seuls environ 10% à 20% du nitrite ajouté à l'origine est détectable de manière analytique. Le niveau de nitrite résiduel diminue davantage pendant le stockage et la distribution.
IV-MODE D'ACTION SUR LA MICROFLORE
L'action inhibitrice du nitrite de sodium sur C. perfringensest au niveau cellulaire.Le nitrite a plus d'un site d'attaque dans les processus métaboliques des cellules bactériennes : a)Les nitrites entravent la conservation de l’énergie en inhibant l’absorption d’oxygène, la phosphorylation par oxydation et le transport actif dépendant des protons ; b) Les nitrites agissent comme découpleurs, provoquant un effondrement du gradient de protons ; c) Les nitrites inhibent certaines enzymes métaboliques.
1-Inhibition du système phosphoroclastique
Dans la cellule, l'oxydation du substrat se produit avec la production concomitante d'adénosine triphosphate (ATP). Ceci peut ensuite être utilisé par la suite comme source d'énergie pour la synthèse de nouveaux matériaux cellulaires nécessaires à la croissance. Dans les Clostridia, l'oxydation du pyruvate en acétate par un système phosphoroclastique est une source importante d'ATP. Lorsque du nitrite est ajouté à une suspension des cellules de C. sporogenes incubées dans un milieu contenant du glucose, il se produit une diminution importante et rapide de la concentration intracellulaire en ATP et une excrétion de pyruvate des cellules. Cette augmentation du pyruvate suggère que le nitrite inhibe le système phosphoroclastique. Le fer est un nutriment essentiel à la germination et à la croissance des spores de Clostridia, ainsi qu'au développement de la toxine botulique. La croissance de C. sporogenes et C. botulinumest inhibée par les nitrites à traversde son interférence avec le système phosphoroclastique, ce qui entraîne une accumulation d'acide pyruvique dans le milieu. L'inhibition est due à une interaction entre le nitrite et la protéine liée au fer intracellulaire, c'est-à-dire la réaction de l'oxyde nitrique avec le fer non hémique de pyruvate: ferrédoxine oxydoréductase. Les nitrites inhibent également l'enzyme fer-soufre, la ferrédoxine, de C. botulinum et C. pasteurianum. Le système phosphoroclastique comprend deux composants: la ferrédoxine et le pyruvate(la ferrédoxine oxydoréductase). Celles-ci contiennent des fractions de fer non-hémique. La ferrédoxine oxydoréductase est une molécule protéique unique contenant de la thiamine pyrophosphate et un fer non hémique. L'oxyde nitrique provoque une inhibition du système phosphoroclastique en interagissant avec ces composants. L'oxyde nitrique est un puissant liant du fer qui peut former des complexes de coordination avec le fer non hémique. La ferrédoxine oxydoréductase semble être plus sensible à l'oxyde nitrique. L'oxyde nitrique réagi avec la protéine contenant du fer dans la cellule de C. botulinum. Les composés nitro aliphatiques et aromatiques inhibent la ferrédoxine du fait que S-nitrosothiolsse forme par réaction avec des résidus de cystéine. L’action bactériostatique du nitrite est probablement due à une interférence avec le métabolisme normal du complexe hypothétique pyruvate-sulfhydryle.
2-Inhibition des systèmes enzymatiques
A un pH acide, le nitrite de sodium se présente sous forme d’acide nitreux, molécule extrêmement réactive capable d’interagir avec une grande variété de substances, notamment la myoglobine, l’acide ascorbique, les phénols, les amines secondaires, les groupes amino et les groupes thiol. Bien que le nitrite de sodium réagisse à la fois avec les groupes sulfhydryle (SH) et les groupes amino primaires à pH 5,5, la réaction avec les groupes SH est plus rapide. L’inhibition de C. perfringens par les nitrites pourrait être due à une réaction de l'acide nitreux avec les constituants de la cellule bactérienne contenant SH. Le nitrite pourrait inhiber les enzymes de la fermentation du glucose, telles que la glycéraldéhyde-3-phosphate déshydrogénase et l'aldolase chez C. perfringens. Les nitrites ont également inhibé l'aldolase de E. coli, Pseudomonas aeruginosa et Streptococcus faecalis. Les nitrites inhibent la nitrogénase de C. pasteurianum, un système qui comprend deux protéines non ferreuses. Cette inhibition était probablement due à la réaction de l'oxyde nitrique avec un composant du système nitrogénase. L'oxyde nitrique est le principe antimicrobien actif du nitrite et le pyruvate décarboxylase peut constituer une cible supplémentaire pour l'inhibition de la croissance par le nitrite. Ces observations sont corroborées par le fait que l'ajout du fer aux viandes contenant du nitrite réduit l'effet inhibiteur de ce dernier. Des agents chélateurs tels que l'ascorbate de sodium, l'éthylènediaminetétraacétate et le polyphosphate renforcent l'action antibotulinale du nitrite. La pigmentation musculaire est due à la myoglobine et, dans une moindre mesure, à l'hémoglobine qui reste après le saignement de la carcasse. Ajouter l'hémoglobine à la viande réduit la quantitéde nitrites après le traitement et diminue l'inhibition de la botuline. L'oxyde nitrique, formé à partir de nitrites résiduels via l'acide nitreux, réagissent avec le fer extracellulaire, bloquant ainsi une étape métabolique essentielle à la croissance. Cette réaction pourrait impliquer le fer dans la ferrédoxine ou une enzyme dans laquelle le fer joue un rôle essentiel. L’utilisation de fractions sanguines augmentant les concentrations de fer dans le bœuf à partir de 30 µg / g entrave l’efficacité antibotulinale du nitrite de sodium de 156 µg / g. Les enzymes inactivées par les nitrites sont associées à la respiration. L'agent inhibiteur actif en dehors de la cellule est étroitement corrélé à l'acide nitreux, alors que le mécanisme d'action peut varier pour différents types de microorganismes physiologiques. Les nitrites inhibent le transport actif, l'absorption d'oxygène et la phosphorylation oxydative de P. aeruginosa en oxydant le fer ferreux d'un porteur d'électrons, tel que la cytochrome oxydase, en forme ferrique. Comme le transport du glucose chez Streptococcus faecalis et Streptococcus lactis ne dépend pas du transport actif ni des cytochromes, les nitrites ne peuvent pas inhiber ces organismes. Les nitrites inhibent par contre le transport actif de la proline dans E. coli, mais pas la translocation de groupe par le système phosphoénolpyruvate: phosphotransférase. L'inhibition d'autres enzymes, en particulier celles contenant des groupes sulfhydryle, peut être obtenue, mais ces effets se produisent généralement à des concentrations plus élevées en nitrites. Staphylococcus lactisest hautement résistante aux nitrites, bien que l'aldolase soit sensible aux nitrites. Cela suggère que ces streptocoques sont imperméables aux nitrites.
V-ASPECTS SANITAIRES ET LEGISLATIFS
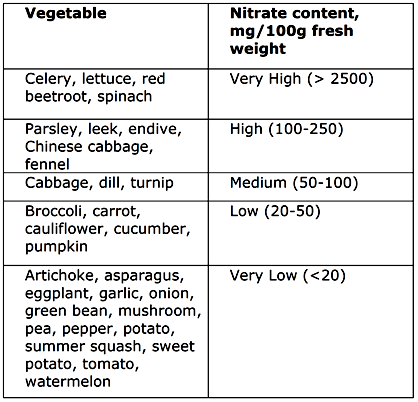
Les additifs alimentaires et les composants alimentaires peuvent présenter deux types d’avantages pour la santé: (i) ceux qui préviennent ou réduisent l'incidence de maladies spécifiques et (ii) ceux qui fournissent une nutrition améliorée. Il s'agit d'une tentative courante de développer un agent qui inhibe ou inactive les organismes indésirables, mais présente une faible toxicité pour l'homme lorsqu'il est ingéré. Les nitrites proviennent de différentes sources : 39% de la viande séchée, 34% de produits de boulangerie et des céréales et 16% des légumes. En effet, le nitrate est important dans l’ensemble, car il se trouve en quantités substantielles dans des aliments naturels (tableau 1 et 2), tels que les légumes à feuilles vertes et les tubercules, et parfois dans l’eau.
Tableau 1 : Quantités de nitrates dans les végétaux
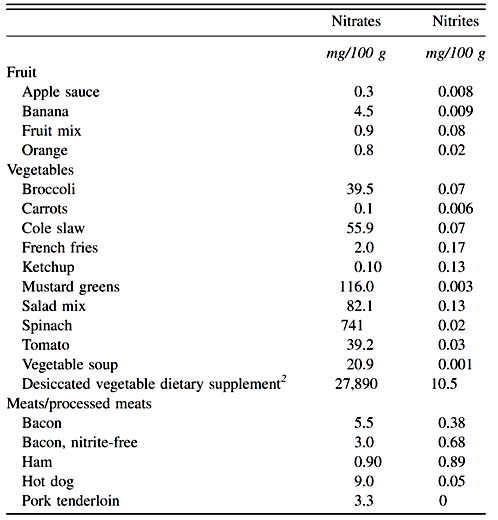
Cependant une ingestion prolongée de nitrite ou nitrate de sodium provoque une méthémoglobinémie, en particulier chez les nourrissons. La méthémoglobinémie entraîne la production d'hémoglobine anormale. L'effet indésirable majeur des nitrites est la possible induction du cancer. Chez le rat, l’ingestion de 250 à 2000 ppm de nitrites augmente l'incidence des lymphomes quand ces quantités lui sont administrées avec la nourriture ou l'eau. Les nitrites entraînent la formation de N-nitrosamines cancérogènes avec des amines secondaires ou avec des substituts d'amides pour former des nitrosamides. Plus de 65 types de nitrosamines différentes détectées dans divers aliments, notamment le fromage, la viande, les champignons et les boissons alcoolisées, se sont révélées cancérigènes. Des études épidémiologiques ont indiqué un lien possible entre l'exposition à des taux élevés de nitrites et une incidence élevée de cancers de l'estomac et de l'œsophage. Un autre effet bien connu des nitrites est l’abaissement du transport de l’oxygène par la circulation sanguine par le mécanisme oxydant de l’hémoglobine en méthémoglobine. Ainsi, le niveau de nitrites devrait être réduit dans les produits durcis. A cet effet, des ascorbates ou des érythorbates sont ajoutés pour réduire la formation de nitrosamine. 30 mg de nitrite de sodium peut provoquer une urticaire, des troubles intestinaux ou des maux de tête. Ceci peut aussi provoquer une anoxie cellulaire et inhiber les activités enzymatiques protectrices de la muqueuse intestinale entraînant une augmentation de la perméabilité de la muqueuse à d'autres antigènes. De plus, le nitrite de sodium peut d'une manière ou d'une autre renforcer l'effet de l'histamine présent dans de nombreux aliments. La dose létale de nitrites chez l’homme est de 32 mg / kg de poids corporel. En 1973, l'USDA a créé un groupe d'experts sur les nitrates, les nitrites et la nitrosamine. Ils ont conclu que: i) l'utilisation de nitrate de sodium devrait être arrêtée dans tous les produits à base de viande et de volaille, ii) le niveau de nitrite autorisé pour le traitement de la viande devrait être limité à 156 µg / g dans les produits stériles mis en conserve, iii ) la teneur en nitrites résiduelle autorisée devrait être réduite de 200 à 100 µg / g dans les saucisses cuites, de 125 µg / g dans les produits en conserve et saumurés, et de 50 µg / g dans les produits stériles en conserve, et (iv) ajouter du nitrite de sodium (120 ppm) et du nitrite de potassium (140 ppm) au bacon avec de l'ascorbate ou de l'érythorbate de sodium (550 ppm) pour aider à prévenir la formation de nitrosamine.
Tableau 2 : Teneurs moyennes en nitrates et en nitrites d'échantillons de consommation courante de fruits, de légumes, de viandes et de produits carnés
La réglementation de 1986 sur les nitrites pour le bacon autorise l’un des types suivants: (i) 120 ppm de nitrite de sodium ou 148 ppm de nitrite de potassium plus 550 ppm d’érythorbate ou d’isoascorbate de sodium, (ii) 100 ppm de nitrite de sodium ou 123 ppm de nitrite de potassium plus 550 ppm de sodium érythorbate ou isoascorbate si la démonstration d'un contrôle de processus adéquat est réalisée, ou (iii) 40 à 80 ppm de nitrite de sodium ou 49 à 99 ppm de nitrite de potassium plus 550 ppm d'érythorbate ou d'isoascorbate de sodium plus 0,7% de saccharose et une culture bactérienne d'acide lactique (Pediococcus) . La teneur en nitrites autorisée est au maximum de 10 ppm chez le thon fumé et de 200 ppm (maximum 500 ppm) chez le poisson fumé, le saumon, l'alose, la morue et dans les mélanges de salaison faits maison. Le niveau chez le mulet fumé est fixé à 100-200 ppm. L'utilisation de nitrites dans d'autres produits est limitée à une limite résiduelle maximale de 200 ppm. Les efforts de développement des produits ont abouti à une toute nouvelle génération de produits à base de viande salée, faibles en gras et formulés avec des ingrédients jamais utilisés auparavant. La teneur moyenne en nitrites résiduels dans les viandes séchées est de 52,5 ppm, tandis que dans les saucisses est entre 0 à 195 ppm. Il est raisonnable de conclure que la teneur en nitrites résiduelles actuelle des charcuteries vendues au détail aux États-Unis est d’environ 10 ppm. Ce changement résulte sans doute (i) d'une réduction des nitrites en entrée, (ii) d'une utilisation accrue d'ascorbates, (iii) d'un meilleur contrôle du procédé et (iv) d'une formulation modifiée. La valeur moyenne des ascorbates résiduels est de 209 ppm, soit près de 40% de l’ajout maximum autorisé de 550 ppm. Les ascorbates couramment utilisés sont l'acide ascorbique, l'ascorbate de sodium, l'acide érythorbique et l'érythorbate de sodium. La formation intragastrique de N-nitrosamines chez l'homme surgie avec des doses plus élevées de nitrate, mais l'acide ascorbique inhibe leur formation.
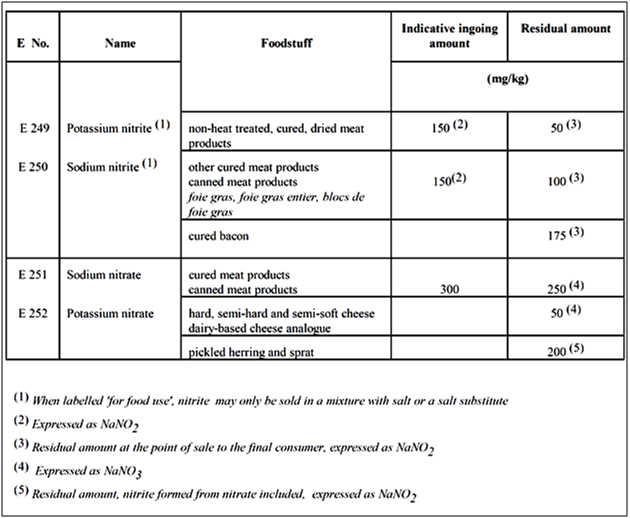
Tableau 3 : Quantités indicativeslimites d'entrée et quantités résiduelles de nitrates et de nitrites conformément à la directive 95/2 / CE
L'oxyde nitrique est synthétisé dans le corps humain et joue un rôle important dans plusieurs fonctions physiologiques. Le nitrite et ses produits de réaction sont importants pour la physiologie humaine. On sait que l'oxyde nitrique se forme dans le corps humain à partir de nitrite. Les avantages de l'oxyde nitrique sont les suivants: (i) il s'agit d'un messager biologique important pour les fonctions physiologiques de la neurotransmission, de la coagulation sanguine, du contrôle de la pression artérielle et du système immunitaire et (ii) la génération du nitrite salivaire à partir du nitrate alimentaire peut également fournir une protection significative contre les agents pathogènes intestinaux chez l’être humain. Dans certains cas, les risques comparatifs sont évidents. Le risque d'utiliser des nitrites et de contracter le cancer suite à une exposition à des nitrosamines doit être mis en balance avec le risque de ne pas utiliser de nitrites et d'acquérir du botulisme à partir de viande séchée. A cet effet, les risques comparés sont plus obscurs ou difficiles à quantifier.
Le tableau 3 exhibe les quantités indicativeslimites d'entrée et quantités résiduelles de nitrates et de nitrites conformément à la directive 95/2 / CE. La DJA de l'OMS pour les nitrates (0 à 3,7 mg / kg) correspond à 222 mg de nitrates pour un adulte de 60 kg. En fait, une portion d'épinard couramment consommée dans une portion de salade peut dépasser la DJA pour le nitrate. Le fait que les modes de consommation typiques des légumes et des fruits dépassent les limites réglementaires pour les nitrates alimentaires remet en question la logique des réglementations actuelles en matière de nitrates et de nitrites. La base physiologique de la régulation de la consommation humaine d'aliments végétaux contenant des nitrates et des nitrites devrait être réévaluée pour inclure les avantages potentiels pour la santé.
VI-CONCLUSIONS
Malgré la démonstration des rôles physiologiques des nitrates et des nitrites dans la fonction vasculaire et immunitaire, les sources alimentaires de nitrates et de nitrites en tant que composants diététiques sains n’ont guère retenu l’attention. La pratique discutable de l'inférence causale en ce qui concerne le rôle étiologique des nitrates et nitrites alimentaires dans la méthémoglobinémie et le cancer a eu un effet néfaste sur la recherche soutenant les avantages pour la santé des aliments contenant des nitrates et des nitrites. Cela s'est produit malgré les avantages observés des nitrates et des nitrites en thérapie médicale. En effet, les données tirées d'études épidémiologiques d'observation et d'études cliniques chez l'homme confirment l'hypothèse selon laquelle les nitrates et les nitrites d'origine végétale jouent un rôle physiologique essentiel dans le soutien de la santé cardiovasculaire et de la fonction immunitaire gastro-intestinale. La force de la preuve établissant un lien entre la consommation d’aliments à base de plantes contenant des nitrates et des nitrites et des effets bénéfiques sur la santé plaide en faveur de la prise en compte de ces composés en tant que nutriments.
















