I-INTRODUCTION
La coloration des aliments a commencé par la conservation de la viande et du poisson par salaison ou fumage il y a environ 17 000 ans. Cependant historiquement, c’est les Egyptiens qui étaient les premiers à utiliser des colorants pour augmenter l'attrait de certains produits alimentaires. Puis les Romains ont eu également recours aux colorants pour la conservation et l'amélioration de l'apparence de leurs aliments. Les premiers colorants artificiels et synthétiques datent donc du XVIIIe, XIXe et XXème siècle, et sont, au départ, préparés à partir des produits de distillation de la houille.
A l’Antiquité, l’être humain ajoutait des matières colorantes pour teindre les vins et les rendre plus épais. Le safran, colorant végétal de couleur jaune et épice, était déjà utilisé par les Egyptiens pour colorer les aliments. Au XIIe siècle, il était l'objet d'un commerce actif en Provence, où les Phocéens l'avaient importé d'Asie. Au XVIIIe siècle, on colore le beurre avec des barbottes et du safran, et on utilise pour la coloration du beurre les fleurs jaunes de renoncule, considérées d'ailleurs à l'époque comme dangereuses. Le reverdissage des légumes est pratiqué depuis l'Antiquité, le nitre de chalastra ou le nitre d'Egypte est employé dans divers aliments et il donne aux choux une couleur plus verte. Aux XVIIIe et XIXe siècles, le reverdissage des légumes est largement pratiqué en Europe, les aliments sont plus estimés quand ils possèdent une belle couleur verte, notamment les haricots verts et les cornichons. Il arrive que les vendeurs les font bouillir dans des vaisseaux de cuivre avec du vinaigre pour leur donner cette couleur verte, ce qui les rend très vénéneux. Des études scientifiques ont par la suite montré que le cuivre est moins nocif qu'on ne le pensait à l'époque. Les légumes sont toujours reverdis par les sels de cuivre dans certains pays.
C’est alors au XVIIIe siècle que le premier colorant artificiel est créé, c’est-à-dire un colorant produit par l’art de l’homme et qui n’existe pas dans la nature donc sous forme de colorant naturel. C'est un marchand berlinois, du nom de Diesbach, qui découvre par hasard, en 1710, comment fabriquer un bleu artificiel qu'on appellera « bleu de Prusse ».
Ce composé résulte accidentellement d'une combinaison chimique de prussiate, de potasse et de sels ferreux. C’est un matériel qui est principalement utilisé comme pigment bleu foncé en peinture. D'autres chercheurs allemands suivront la même piste de recherche pour créer d’autres colorants artificiels.
Jusqu'en 1850, les colorants ont été quand même d'origine naturelle. C'était des colorants pour la plupart organiques qui provenaient de végétaux comestibles (carotte [orange], betterave [rouge], peau de raisin noir [noir], ...), d'extraits d'origine animale ou végétale non habituellement consommée (rouge cochenille provenant d'un insecte d'Amérique centrale [Coccus Cacti], stigmate de crocus [safran], ...) et du résultat de la transformation de substances naturelles (caramel [marron], ...).
Ensuite, c’est à partir de 1856 que sont apparus les colorants synthétiques. À Londres en 1856, William Henry Perkin, un jeune chimiste anglais âgé de 18 ans, travaille sur une forme synthétique de la quinine dans le but de trouver une substance anti-malarienne, pour un concours lancé par son professeur August Wilhelm Von Hofmann. Il n'arrivera pas à synthétiser la quinine, mais il fera par contre une découverte beaucoup plus intéressante. Au cours de ses essais, il oxyde l'aniline par le dichromate de potassium. Dans ces conditions, l'aniline réagit avec les impuretés de toluidineprésentes dans le mélange pour produire un solide noir, résultat bien souvent obtenu lors d'échecs de synthèses organiques. Cependant, Perkin découvre que certains composants étaient solubles dans l'alcool et donnaient une solution violette, ce qui prouvait son efficacité en tant que colorant pour la laine ou la soie. Ses recherches donnent ainsi naissance à l’existence de la mauvéine.
Suite à cette découverte révolutionnaire, Perkin quitte son poste en tant qu’élève de Hoffmann et fonde avec son père et son frère une compagnie pour commercialiser la mauvéine. Pendant que l’usine est en construction, Perkin découvre une préparation industrielle du colorant et il découvre par la même occasion de nouvelles techniques de teinture. Ce colorant est à l'époque un grand succès. Il est fabriqué en 3 étapes, à partir du benzène et de réactifs peu coûteux. Le mélange est fait de sulfonitrique, de limaille de fer, d'acide acétique et de bichromate de potassium. Le benzène s’obtient par distillation du goudron (résidu de la fabrication du gaz d’éclairage et ne coûtait pas très cher). La mauvéine se fait fabriquer alors dans la première usine de colorant de synthèse, à Greenford Green, près de Greenford, à environ 15 km à l'ouest du centre de Londres. Perkin gagne ainsi beaucoup d'argent et par suite de son succès, de nombreuses usines se construisent en Grande Bretagne, en Allemagne et en France. Six ans après que Perkin a découvert la mauvéine, en 1862, la reine Victoria, reine du Royaume-Unis de 1837 jusqu’à sa mort en 1901, apparaît à la Royal Exhibition dans une robe en soie colorée avec de la mauvéine. Suite à cette action, le mauve devient en France la couleur préférée de l’époque de Napoléon III. Cette découverte, faite dans un laboratoire rudimentaire, jeta alors les bases de la fabrication des teintures, des pigments synthétiques et de l’industrie mondiale des produits chimiques de synthèse. Des traditions séculaires étaient bouleversées. La mauvéine connu un succès immédiat et fut le point de départ, en Europe, d’une industrie qui produisit de nouveaux colorants. Les possibilités d'inventions chromatiques deviennent presque inépuisables. Dès le milieu du XIXe siècle, l'Angleterre s'empressera de distribuer ces colorants, suivie de près par des firmes françaises, suisses et allemandes. Cette période fébrile verra s'accroître rapidement le nombre de nuances disponibles pour la teinture.
Pendant près d'un siècle, soit de 1850 à 1950, les fabricants de colorants utilisent exclusivement des produits dérivés de la houille de charbon. À partir de 1950, ils utiliseront plutôt des dérivés du pétrole qui offriront de nouvelles possibilités.
Plus tard, les études sur les colorants chimiques conduisent également (et de manière accidentelle) au développement de la chimiothérapie moderne.
La découverte de Perkin marquait la naissance de l’industrie chimique organique qui a connu sa suite grâce à l'Allemagne qui développa une importante industrie de chimie organique qui conçus plusieurs autres colorants. La France, qui ne croyais pas au développement de cette chimie et dont le chimiste Berthelot ne croyait pas aux atomes, fût fortement retardée dans ce domaine.
En 1869, les chimistes Allemands Carl Graebe et Carl Liebermann réussissent à synthétiser l'alizarine, un colorant rouge d'origine végétale, extrait de la racine de la garance des teinturiers (une plante vivace de la famille des Rubiacées). Le résultat obtenu se nomme la laque de l’alizarine et a pour conséquence de faire prendre conscience à la France que le développement de la chimie organique est inévitable.
En effet, ce pays soutient les agriculteurs mais il se rend très vite compte que les produits de synthèses sont nettement supérieurs car ils sont moins coûteux. En 1878, les producteurs de garance produisent 500 tonnes par ans alors que le produit de synthèse correspond à 30 000 tonnes.
En 1870, Adolf von Baeyer réussis à synthétiser l'indigo. Cette nouvelle découverte ruine tous les producteurs d'indigo. En effet, ce colorant envahi le marché et le gouvernement ne peut lutter contre le progrès. Le colorant de synthèse a définitivement vaincu l'indigo naturel. Indigo est souvent qualifié de « septième couleur » de l'arc-en-ciel depuis Isaac Newton, sa couleur correspond à ce que nous appellerions bleu ou bleu-violet. De nos jours c’est la couleur de base des jeans qu’on porte de nos jours. Petit à petit, les colorants synthétiques deviennent de plus en plus présents dans de nombreux domaine. En 1882, le jaune quinoléine, appelé aujourd'hui E104, fut le premier colorant alimentaire à être synthétisé.
Les colorants sont utilisés pour colorer divers aliments. En effet, nous associons souvent la couleur de nos aliments avec leur goût. L’industrie alimentaire a donc très rapidement vu l’intérêt de rajouter des colorants aux aliments pour attirer les consommateurs. Comme, par exemple, pour le sirop de menthe qui est à la base jaunâtre alors que nous associons la menthe à la couleur verte. Depuis la découverte de Perkin, on observe une utilisation massive de colorant dans notre alimentation. En effet, les colorants naturels ne se conservent pas très bien dans le temps et leur coût est important, cette découverte est donc un progrès considérable en partie dans ce domaine.
Devant la multiplication des substances proposées, l'idée de la liste positive fait son chemin et est adoptée en France en 1912. De nombreux amendements viennent modifier cette liste, à cause de problèmes toxicologiques, qui entraînent notamment l'interdiction du jaune de beurre. En 1962, la CEE propose une liste de colorants qui est adoptée en France en 1963. Elle comporte 38 colorants d'origine variée. En 1977, et sur recommandation de la CEE, neuf colorants sont retirés de la liste des additifs autorisés, pour cause de dossier toxicologique incomplet (chrysoïne S, jaune solide, orange GGN, orseille, écarlate GN, ponceau 6 R, bleu anthraquinonique, noir 7984, terre d'ombre brûlée).
Depuis, la législation européenne a encore évolué. La dernière phase de proposition du Parlement Européen sur les colorants fut émaillée par le dépôt de plus de cent amendements en première lecture par les socialistes et les écologistes, réclamant des restrictions plus sévères sur l’emploi de ces substances et l’interdiction totale d’un certain nombre d’entre eux. Sous la pression de l’industrie agro-alimentaire, la moitié des amendements fut supprimée. Finalement, la directive sur les colorants diviser en 5 annexes a été adoptée le 30 Juin 1993 qui liste les 43 colorants autorisés et qui consiste à expliquer l’emploi des colorants est interdit, où seuls certains colorants sont autorisés, les 10 colorants autorisés uniquement pour des usages précis, et les 33 colorants généralement autorisés. A l'heure actuelle, 90 % des colorants sont synthétiques.
Au cours de la première partie sur les colorants alimentaires naturelles, on a traité les colorants naturels les plus utilisés dans l’industrie alimentaire et leurs applications. De nos jours ces colorants sont en train de gagner de plus en plus de terrain au niveau des marchés à l’échelle mondiale due à l’évolution des intérêts du consommateur. Ce dernier est de plus en plus concerné par sa santé que par ces gouts. Ainsi l’intolérance à certains additifs synthétiques par le corps humain leur a couté un rejet quasi radical du marché. Cependant, l’appréciation sensorielle est bien sûr toujours très sollicitée pour certains types d’aliments exigeant l’utilisation de colorants synthétiques. Cet ainsi qu’au cours de la seconde partie de cet article, les colorant issues du brunissement et des colorants synthétiques seront traités en détails.
II-LE BRUNISSEMENT
Deux types de brunissement se produisent dans les aliments : Un est causé par l'activité enzymatique et l'autre par la réaction de Maillard et d'autres réactions chimiques. Le brunissement peut être souhaitable ou indésirable selon la matière première ou le produit concerné. Son étendue dépend du pH, de la température, de l’activité de l’eau (aw) et de la composition du produit. En effet, les deux types de brunissement se comportent différemment vis-à-vis de l'aw.
L'activité de la réaction enzymatique augmente avec aw tandis que le brunissement non enzymatique commence à une aw faible et atteint son maximum à aw ≈ 70%. Les deux types de brunissement peuvent se produire mais pas nécessairement de façon simultanée. Des études sur la mei-prune chinoise ont montré que le brunissement enzymatique se produit aux premiers stades du saumurage à sec, mais les réactions de Maillard ont lieu à des stades ultérieurs.
1-Brunissement enzymatique
Les fruits et légumes crus exposés à l'air sont sujets à l'oxydation activée par le biais d’enzyme, qui produit des pigments de mélanine de couleurs brunes et noires. Les ecchymoses du fruit ou du légume entier, ainsi que le tranchage et le dépulpage, augmentent l'activité enzymatique. Ces réactions peuvent être retardées ou évitées en éliminant l'air grâce à un emballage étroit ou un stockage sous l'eau. L'enzyme peut être inactivée, par exemple, en ajoutant du jus de citron. Le taux de brunissement provoqué par les enzymes peut augmenter rapidement lorsque la congélation est suivie d'un dégel. Ceci est dû aux dommages cellulaires résultant du processus de congélation. Les fruits, qui doivent être consommés sans être cuits, ne sont pas blanchis avant d'être congelés car leur goût se modifie significativement. Le sulfite, sous forme d'anhydride sulfureux ou de bisulfite de sodium, est couramment utilisé pour atténuer le brunissement des fruits et des légumes frais. Une concentration de 10 ppm de SO2 est suffisante, mais des concentrations plus importantes sont souvent utilisées. Le S02 réagit avec les quinones et empêche leur implication dans les réactions de brunissement. Cependant, si ce dernier s’est déjà entamé, le S02 est oxydé impliquant sa désactivation en tant qu'inhibiteur. Des concentrations élevées de sel (supérieures à 10%) peuvent inhiber l'action des enzymes, mais ce niveau est trop élevé pour la plupart des aliments de point de vue sensoriel et technologique. Lorsque la fonctionnalité des protéines est importante, comme pour les céréales, le traitement thermique ne peut être utilisé pour le blanchiment. Les fruits destinés à être cuits après le processus de congélation / décongélation peuvent être blanchis. L’utilisation des traitements de blanchiment avant tout procédé ultérieur sont conçus afin d’inactiver les enzymes le plus tôt possible dans le processus.
Le brunissement enzymatique n'est pas toujours indésirable, en effet, la qualité du jus de pomme, des dattes, des pruneaux, des raisins secs, de la sauce de soja et du thé noir en dépendent. Ces réactions contribuent également à la qualité des boissons fermentées telles que la bière, le cidre et le poiré. Par conséquent, l’élimination du brunissement induit par les enzymes est nécessaire pour certains produits, mais son utilisation est essentielle pour que d’autres aliments puissent être transformés.
L'enzyme polyphénol oxydase (PPO) est très répandue dans la nature et est tenue pour responsable de la plupart des brunissements enzymatiques. La compréhension du processus est incomplète car son rôle est complexe. Elle se présente sous de nombreuses formes et est responsable de la catalyse d’un certain nombre de réactions. Les modifications oxydatives catalysées par la PPO produisent des o-quinones, qui interagissent pour former des polymères bruns de poids moléculaire élevé. Ils forment également des complexes bruns avec les acides aminés et les protéines, et participent également à d'autres réactions d'oxydation conduisant à des composés incolores.
Il existe plusieurs moyens pour contrôler le brunissement enzymatique. Les additifs contenant des sulfites ont été largement utilisés pour que les fruits et légumes conservent leur apparence fraîche, tandis que l’oxygène peut être exclu des surfaces coupées par immersion dans de l’eau, du sirop, de la saumure ou par désoxygénation sous vide. Le cuivre présent dans l’enzyme PPO joue un rôle essentiel dans le brunissement, mais son étendue peut être réduite par chélation. Le blanchiment désactive les enzymes par traitement thermique, mais cela a également pour effet de ramollir le produit. La réduction du pH en dessous de 3 inhibe les enzymes, l'activité la plus importante se situant entre 5,0 et 7,0. Le jus de citron et l'acide citrique sont des matériaux pratiques, car ils réduisent non seulement le pH, mais chélatent également le cuivre présent dans certaines enzymes. Le brunissement du jus de citron est dû à une action non enzymatique. Il a été constaté qu'il était possible de conserver des pommes de terre fraîches pelées et tranchées pendant 14 jours au réfrigérateur, sans coloration. En effet, ces pommes de terre ont été trempées dans un bain contenant : 1) de l'acide ascorbique pour agir en tant que désoxygénant et pour réduire les o-quinones formées par la PPO et les composés phénoliques d'origine; 2) del’acide citrique pour abaisser le pH, chélater le cuivre et ralentir l'autoxydation de l'acide ascorbique; et 3) du sorbate de potassium, pour contrôler la croissance des moisissures et des levures.Les tranches ont ensuite été égouttées et emballées sous vide dans des sacs multicouches en polyoléfine. Le produit doit être utilisé directement car les tranches ont montré des signes de brunissement dans les 10 à 30 minutes suivant l’ouverture de l’emballage. Le trempage permet une pénétration limitée de ces produits chimiques par rapport à celle du sulfite, mais des améliorations ont été obtenues dans les bouchons de pommes de terre et de pommes par infiltration sous pression. Des études sur l'inactivation de la PPO de la banane ont montré que l'énergie d'activation augmente de 18 kcal / mole, à des températures comprises entre 42 et 72 ° C, à 85 kcal / mole au-dessus de 72 ° C. Il se produit des changements marqués dans la structure protéique de l'enzyme, ce qui la rend plus sensible à la chaleur. En conséquence, tout processus de blanchiment devrait impliquer des températures supérieures à 70-75 ° C. Le temps nécessaire à l’inactivation complète de la PPO par la chaleur de divers jus de fruits varie considérablement. À une température de 75 ° C, il faut moins d'une minute pour obtenir un jus de pêche et un jus de pommeclairs, tandis que plus de 100 minutes sont nécessaires pour une pomme et une prune troubles. Lors de la préparation de jus et de purées de poires, la couleur se détériore rapidement sous l’action de la PPO. Le blanchiment immédiat après la macération du fruit est un moyen de contrôle efficace. Cependant, si le brunissement a déjà commencé avant le blanchiment, un inhibiteur du brunissement doit être ajouté pour stabiliser le produit pendant le traitement thermique. L'acide ascorbique est un moyen efficace mais temporaire pour inhiber la PPO, mais la qualité est améliorée par l'ébullition du jus. La couleur est un attribut sensoriel important du jus de pomme. Le développement de la couleur dans de tels produits est un processus complexe dans lequel des composés phénoliques participent à des réactions induites par la PPO. Tous les composés phénoliques ne sont pas bruns et certains, comme l'acide chlorogénique, agissent en tant qu'intermédiaires. Il est aussi à noter que les différences de couleur et de teneur en phénol du jus de pommes de table sont sensibles aux cultivars.
En outre, l’oxydation de la purée produit un jus de couleur plus claire que celle du jus. Un contrôle minutieux de l'oxydation de la purée peut aboutir à une couleur finale bien contrôlée. Le brunissement du jus de raisin pendant le traitement n'est pas souhaitable. Des enquêtes portant sur cinq variétés réalisées sur trois ans ont révélé l'extrême complexité du développement de la PPO, du stade vert du raisin au fruit mûr. Les niveaux d'activité sont dépendants de l'année, probablement affectés par le climat et la variété. Le brunissement des raisins Sultana est dû à la PPO située principalement dans la peau et à des réactions de brunissement non enzymatiques. La noirceur des raisins secs résultant du séchage est liée à l'activité résiduelle de la PPO. Les raisins secs de couleur claire sont traditionnellement produits par le traitement au SO2, ce qui empêche les deux types de brunissement de se produire. La quantité de S02 requise peut être réduite en augmentant les taux de diffusion de l’eau et en diminuant le temps de séchage. Ceci peut être réalisé par une émulsion d’huile tensioactive, qui enlève la couche externe cireuse et diffuse dans le raisin. La couleur du thé noir dépend de l'initiation et du contrôle de l'action des enzymes. Deux technologies conventionnelles sont utilisées dans sa fabrication et les deux impliquent le fait d’endommagerla feuille pour libérer les composants de la cellule. Dans la méthode orthodoxe, un laminoir est utilisé pour tordre les feuilles et endommager les membranes cellulaires sans affecter grandement la conformation des feuilles. La méthode écraser – déchirer - tordre ou CTC, par contre, implique le déchiquetage de l'épiderme des feuilles de la tige, ce qui entraîne la libération de quantités importantes de contenu de cellules de la tige. La couleur du thé résulte d'un certain nombre de types de réactions de base. Premièrement, les acides et les enzymes de dégradation convertissent les pigments verts de chlorophylle en phéophytine et phéophorbide jaunes / gris / bruns. Deuxièmement, la PPO catalyse l'oxydation des ftavanols de thé pour produire des pigments rouges jaunâtres. Troisièmement, ces réactions se poursuivent pendant les étapes de fermentation et d’évaporation de l’eau, lorsque la couleur passe du rouge cuivré au brun. La conversion des catéchines du thé en théafavines et en théarubigines au cours de la deuxième et troisième étape contribue de manière très significative à la couleur et à la saveur.
Les feuilles sont déclenchées à la fin du processus pour mettre fin à l'activité de la PPO. Les conditions de croissance ont un effet sur la composition chimique. Par exemple, des thés noirs avec une teneur en théaflavine plus élevée et des concentrations réduites en théubigine peuvent être produits à partir d'arbustes cultivés à l'ombre artificielle. Bien que la teneur en théaflavine du thé brut contribue positivement à la valeur du thé cru, d'autres facteurs jouent également un rôle majeur. Ceci inclut la variation génétique des plantes du thé, la gamme et la complexité des réactions, les pigments (et les arômes) formés lors de la fabrication, ainsi que la sensibilité des consommateurs à la couleur (et à la saveur) du thé infusé. Ceci explique pourquoi les thés noirs sont mélangés avant la vente au détail. Pour les aliments déshydratés pour lesquels le brunissement n'est pas souhaitable, il est préférable que les enzymes soient inactivées par la chaleur avant la poursuite du traitement. La valeur de l’aw doit être proche autant que possible de la valeur d'humidité de la monocouche, et des mesures doivent être prises pour empêcher la récupération de l'humidité.
2-BRUNISSEMENT NON ENZYMATIQUE
Suite à un traitement thermique, un produit alimentaire subit une suite de changements dues au brunissement. Ceci est causé par les réactions de Maillard et, à mesure que la température augmente, par caramélisation, pyrolyse et ignition. Les principales réactions non enzymatiques impliquées dans la préparation et la conservation des aliments sont:
- Les réactions de Maillard glucides / acides aminés, qui entraînent une dégradation indésirable, par exemple dans les jus de fruits, le lait concentré et les produits séchés conservés à une température trop élevée.
- La caramélisation, qui implique la dégradation thermique des sucres sans participation d'amine.
- Les effets des produits de décomposition oxydative lipidiquesur les protéines.
Lors de la production de sucre, des matières colorantes sombres indésirables sont formées par les réactions de Maillard, la caramélisation et la formation de composés de polyphénol et de fer. Le brunissement de Maillard peut être rencontré dans au moins trois domaines différents de l’industrie alimentaire:
- Le développement d’arômes et de saveurs lors de la torréfaction, de la cuisson au four et de la cuisson.
- La création d’arômes des aliments non traditionnels;
- L’effet sur la couleur et / ou le goût de sousproduit indésirable suite àla transformation des aliments.
La fumée de bois a longtemps été utilisée comme méthode de conservation du poisson et de la viande. La fumée contient des phénols, qui ont des propriétés bactéricides et antioxydantes. Pour une bonne stabilité au stockage, l'activité de l'eau doit être suffisamment faible pour diminuer l'activité microbiologique. Le sel a traditionnellement été utilisé à cet effet, mais l'avènement de la réfrigération a permis d'utiliser des concentrations de sel plus faibles au cours des dernières années.
Les produits fumés peuvent être à faible teneur en humidité et durs, ou semi-humides et salés. Le brunissement du filet de saumon, parfois encouragé par l'ajout de sucre, se produit pendant le fumage. Cela conduit à une variation de couleur des tranches du saumon fumé. Ils sont en partie roses et en partie marrons. Alors que la cuisson et la mise en conserve se dispersent considérablement, la lumière diffuse beaucoup moins lors du fumage. L’apparence d’une tranche de saumon fumé de bonne qualité est due à l’interaction délicate entre le pigment rose naturel, le brunissement imposé et le caractère translucide de la chair. L'utilisation de saumon de mauvaise qualité peut conduire à la production de tranches fumées d'aspect médiocre. À titre d’exemple, suite à de mauvaisesconditions de stockage du poisson cru, on peut assister à une augmentationde ses propriétés de diffusion de la lumière. Les tranches provenant du côté fumé du poisson cru, qui ont subi un cycle de température pendant leur stockage au congélateur, peuvent avoir un coefficient de diffusion de la lumière bien plus élevé que la normale. Le trajet de la lumière dans une telle tranche est moindre car la transmittance interne est diminuée. Cela conduit à une diminution de l'absorption nécessaire à la perception de la teinte rose pâle. Il peut en résulter une apparence légèrement boueuse et très indésirable. L'apparence du côté fumé n'est pas affectée, car on ne peut pas voir l'augmentation de la diffusion de la lumière dans la chair derrière l'aspect brun foncé de la surface durcie. Dans de nombreux procédés, tels que la cuisson de la viande ou la formation de croûte sur du pain, les réactions de brunissement sont considérées comme un avantage non seulement pour le développement de la couleur, mais également pour la formation d'arôme et flaveurs agréables. Le bœuf subit une combinaison de changements pendant la torréfaction et une large gamme de couleurs est tolérée par le consommateur. La plupart des modifications chimiques qui se produisent pendant la caramélisation se produisent également suite au brunissement de Maillard. Uniquement pour les sucres purs, de nombreuses réactions qui se produisent à des températures très élevées peuvent aussi se produire à de basses températures une fois que des acides aminés se trouvent impliqués. Les réactions de Maillard incluent les aldéhydes, les cétones et les sucres réducteurs, avec les amines, les acides aminés, les peptides et les protéines. En général, les réactifs courants de la filaire alimentaire incluent les sucres réducteurs et les acides aminés. Mauron (1981) a divisé ces réactions en trois phases : a) La phase initiale, qui consiste en des réactions chimiques définies sans brunissement ; b)La phase secondaire se compose de nombreuses réactions impliquant la formation de substances volatiles ou solubles ; c)La phase finale inclue des réactions conduisant à la production de polymères bruns insolubles.
Le stade précoce de la réaction de Maillard est un processus de condensation impliquant des composés d'aldose ou d'hexose carbonyle, dissous du glucide réducteur, et du groupe amino libre de l'acide aminé ou de la protéine. Le produit de condensation perd de l’eau pour former la base de Schiff, qui subit une cyclisation en aldosylamine. Celui-ci subit à son tour le réarrangement d’Amadori en ketoseamines. À ce stade, il n’y a ni brunissement ni changement de goût bien que la valeur nutritive de l’aliment puisse être considérablement réduite. Le stade avancé inclue la forme générale des réactions complexes conduisant à la formation de mélanoïdines brunes-foncées (voir figure 1). Les produits chimiques contribuant aux substances volatiles et à la saveur des aliments se forment tout au long des étapes avancées et finales.
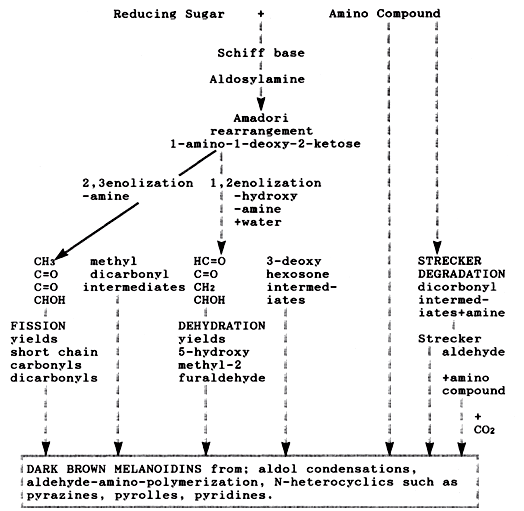
Figure 1: Schémas simplifie des réactions de Maillard par Mauron [Mauron J (1981) The Maillard reaction in food, a criticalreviewfrom the nutritionalstandpoint. Prog Food NutSci 55-35]
Les produits d'oxydation des lipides, en particulier ceux contenant davantage d'acides gras insaturés, peuvent réagir avec les protéines pour former des pigments bruns. Les hydroperoxydes et les aldéhydes formés par l'oxydation peuvent être tous deux responsables d’une telle réaction. Les pigments bruns eux-mêmes retardent l'oxydation des lipides. Par exemple, les produits de réaction de Maillard se sont révélés être des antioxydants efficaces dans des systèmes modèles, des biscuits et des saucisses. Les produits de réaction d’autoxydation lipidique entraînent la formation de pigments chez le saumon lyophilisé. Ceux-ci produisent des antioxydants qui limitent la destruction de l'astaxanthine rouge. Le traitement alcalin utilisé dans la production de protéines produites à partir de nouvelles sources peut également contribuer à la formation de produits induisant le brunissement. Les principaux facteurs contrôlant le développement des arômes brunissants et non-ligneux sont les suivants:
- Le rapport entre les groupes carbonyles réactifs et les groupes amine disponibles.
- Le pH du système.
- La quantité de dicarbonyle présente en raison du traitement préalable.
- Le métal, une catalyse basée sur des couples rédox.
- La quantité d'eau ou d'une autre phase de solvant disponible (par exemple des graisses liquides ou des glycols liquides).
- La viscosité de la phase réactionnelle.
- La température de traitement et de stockage.
a-Le substrat
La prédiction de l'étendue et du taux de brunissement dans les systèmes alimentaires réels n'est pas encore possible en raison de la nature variée du processus, des nombreux facteurs qui y contribuent et de sa sensibilité à l'environnement. L’examen des preuves relatives à la sensibilité des sucres au brunissement non enzymatique a prouvé qu’il est pratiquement impossible de prédire les taux de brunissement absolus dans les systèmes purs, sur la base des taux de réduction de la puissance. Le tableau 1 montre la sensibilité des sucres réducteurs au brunissement non enzymatique. La glycine et chacun des sucres (tous à des concentrations de 0,1 M) ont été chauffés dans un tampon d'acétate 0,2 M (pH 5,0) à 120 ° C pendant 5 minutes. L'étendue du brunissement est liée au pouvoir réducteur des sucres, à l'exception des sucres acides. La dissemblance au niveau du comportement de ces derniers peut être liée aux capacités de transport d'électrons causées par les substitutions d'anneau. Le brunissement de différents sucres avec de la glycine à 50 ° C et les temps nécessaires pour atteindre une absorbance de 10 nm à 450 nm sont présentés dans le tableau 1. Les réactions de caramélisation, bien que normalement considérées comme importantes aux températures élevées, sont significatives à une sensibilité de 0,90 à 55 ° C. Les temps nécessaires à une sélection de sucres pour atteindre une valeur Suvde 0. 40 sont également indiqués dans le tableau 1.
Il est évident que chaque sucre se comporte différemment quand il est soumis à différentes conditions. Pour le brunissement, non seulement les teneurs en sucre / acide aminé sont importantes, mais aussi la caramélisation des sucres peut être importante même aux températures de stockage. Abaisser le pH réduit la caramélisation. Des études portant sur des solutions de sucre (fructose, xylose, glucose, lactose, maltose et saccharose) et de glycine ont permis de conclure que la caramélisation contribuait de manière notable au développement de la couleur totale uniquement dans le système fructose / glycine. Bien que le saccharose ne contienne aucun groupe carbonyle actif, il forme des sucres réducteurs par hydrolyse catalysée par un acide, même à des teneurs en humidité inférieures à 1%. Celui-ci se trouvant en dessous de la couverture monocouche. Ces sucres réducteurs participent aux réactions de brunissement. Avec la glycine, le saccharose produit un noircissement au niveau des systèmes modèles de disques en papier filtre comparables à ceux des sucres réducteurs.
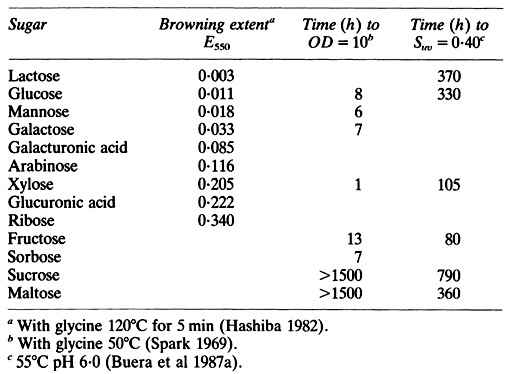
Tableau 1 : Sensibilité des sucres au brunissement non enzymatique par Hashiba[Hashiba H (1982) The browning reaction of Amadori compounds derivedfromvarioussugars. Agri~ BioiChern 46 547-548], Spark [Spark AA (1969) Role of amino acids in nonenzymic browning. J Sci Food Agric 20 308-316], Buera et al [Buera M del Pilar, Chirife Jorge, Risnik Silvia L, Lozano Roberto D (1987) Nonenzymatic browning in liquid model systems of high water activity, kinetics of color changes due to caramelization of various sugars. J Food Sci 521059-1062, 1073]
En utilisant un système modèle similaire, aucune indication d'acides aminés particuliers agissant de manière préférentielle n'a été trouvée. Il est peu probable que la détermination de la teneur en acides aminés des pommes de terre améliore la prévisibilité de la couleur des alevins. La fabrication réussie de frites de pomme de terre nécessite la présence de taux optimaux de sucres réducteurs afin d'éviter un noircissement excessif. Des différences significatives des teneurs en fructose, en glucose et en saccharose des pommes de terre apparaissent selon la variété, la région de culture et la date de récolte. La concentration en sucre peut être réduite par lessivage ou en par le biais d’une réaction enzymatique afin de les réduire aux conditions de stockage contrôlées. L'ajout de glucose et d'acides aminés aux tranches de pomme de terre par infiltration sous vide conduit à un noircissement accru après la friture. Cependant, il a été constaté que le sucre était le facteur limitant du brunissement non enzymatique et il a été conclu que le brunissement, dû à la présence de niveaux élevés de ribose, conduit au rejet de nombreux échantillons de produits de la pêche en conserve, séchés et congelés. Cela indique que les conditions de stockage sont mauvaises avant le traitement. Le ribose est un sucre très réactif. Les réactions d’acides aminés peuvent être diminuées en réduisant la disponibilité des espèces les plus réactives telles que la lysine et la glycine. Il est néanmoins difficile de prédire l'étendue du brunissement à partir d'une connaissance du système protéique présent. Dans un système modèle contenant 30% de protéines, 10% de glucose, 20% de glycérol, 20% de matières grasses et 20% de cellulose, humidifié à uneaw d'environ 0,70, il a été constaté que le taux de brunissement n'était pas lié à la concentration de lysine disponible. Ceci est montré dans le tableau 2.
Comme indiqué, une teneur inférieure en lysine ne conduit pas automatiquement à un brunissement inférieur, mais le brunissement peut être augmenté par addition de lysine libre. La réactivité d'une protéine intacte dépend très probablement de la configuration tridimensionnelle qui est à son tour fonction du pH, de la température, de la disponibilité de l'eau et la présence de divers ions. Le taux de production de pigment est contrôlé par le rapport du composé réducteur disponible à l'amine. Dans des conditions d’humidité intermédiaire pour un système modèle, le taux de formation de pigment accrois linéairement à mesure que le rapport glucose / lysine augmente de 0,5 à 3. Au-dessus de ces taux, Il n’y a pas de formation des pigments.
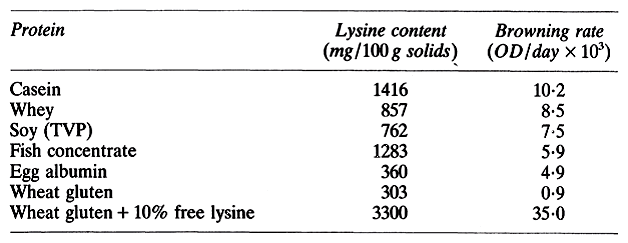
Tableau 2 : Teneur en lysine disponible et taux de brunissement des protéines par Schnickels et al [Schnickels Raymond A, Warmbier Henry C, Labusa Theodore P (1976) Effect of protein substitution on nonenzymatic browning in an intermediatemoisturefood system. J Agric Food Chem 24 901-903]
b-L'effet du pH
La forme réactive des carbonyles peut être minimisée en maintenant le système à un pH inférieur à la valeur dupKa. Cela se produit généralement entre pH 9,0 et 10,5, et garantit que les amines sont dans un état moins réactif -NH3. A des pH beaucoup plus bas, la vitesse de réaction augmente à nouveau car plus de groupes NH2 réactifs sont formés à partir de - NH3. La figure 2présente une courbe typique du taux de brunissement par rapport au pH. Les pH extrêmes sont normalement évités lors de la transformation, bien que l'on obtienne des bretzels et des tortillas au brunissement à faible pH et que les sirops de caramel sont fabriqués à pH élevé. Au fur et à mesure que le pH d’un produit alimentaire modèle (lysine / glucose) à humidité intermédiaire (awentre 0,90 et 0,95) passe de 5,0 à 7,0, il se produit une nette augmentation du brunissement après chauffage entre 35 et 55 ° C. Le taux de brunissement des peptides (glucose / glycine)à pH inférieurs à 6 est supérieur à celui des glucoses / glycines présentant la même concentration molaire. L'inverse a été observé à un pH plus élevé. Plus le nombre d'unités glycine est grand, plus le taux de brunissement est important.
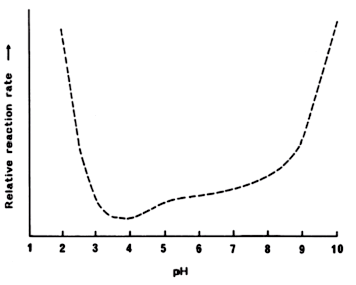
Figure 2 : Effet du pH sur la vitesse de réaction du brunissement non enzymatique par Labuza et Schmidl[Labuza Theodore P, Schmidl Mary K (1986) Advances in the control of browning reactions in foods. In Role of Chemistry in the Quality of Processed Food, eds Owen R Fennema, Wei- Hsien Chang, Cheng-Yi Lii, Westport, Conn: Food & Nutrition Press, 65-95]
c-L'effet de l'activité d'eau (aw)
La stabilité maximale des aliments séchés est obtenue en déshydratant et en maintenant la valeur d'humidité en monocouche. La mobilité des solutés est donc limitée et les groupes réactifs ne peuvent pas s’approcher. Au fur et à mesure que aw augmente, la mobilité augmente et le brunissement peut atteindre une valeur maximale. Si l'effet est encore plus grand, l'effet de dilution diminue les vitesses de réaction. Ceci est illustré à la Figure 3, qui compare le comportement des deux types de brunissement. Ces courbes ont été confirmées lors d'études sur le séchage de raisins sultana. La coloration maximale du jus de pomme par le brunissement non enzymatique dépend de la concentration en jus; elle se produit à une aw comprise entre 0,53 et 0,55 pour des durées de stockage allant jusqu'à 100 jours (figure 3). Il est possible de réduire le taux de brunissement pendant le stockage en utilisant une aw élevée, mais cela n’a aucun intérêt commercial en raison de la viscosité trop élevée. Le stockage à faible concentration est donc préféré. Il a été constaté que le taux de brunissement des produits alimentaires modèles ayant une humidité intermédiaire n’était pas sensible à une aw entre 0,90 et 0,95. Des ingrédients courants modèrent la réactivité à de faibles valeurs de aw. Les glycols peuvent créer un grand volume, diluant et ralentissant ainsi la réaction, tandis que le sorbitol agit en augmentant la viscosité. D'autre part, les graisses liquides peuvent augmenter les taux de brunissement en dissolvant les réactifs. Le lipide agit comme une phase mobile réduisant l’énergie d’activation de la réaction. Le taux maximal de brunissement des pommes de terre augmente avec l’augmentation de la température de séchage. Cela indique que la température devrait être réduite au cours des derniers stades de séchage. Cela est particulièrement vrai lorsque la vitesse de brunissement est maximale pour une teneur en humidité comprise entre 0,1 et 0,2 g / g de matière solide. Alternativement, une température basse peut être utilisée tout au long du séchage. Ces données ont été utilisées pour calculer un modèle d'optimisation dynamique visant à minimiser le brunissement au cours du traitement. Au cours de la déshydratation du chou, les produits de dégradation de l'acide ascorbique réagissent avec les acides aminés. Cela provoque une décoloration du produit qui passe du rouge au brun pendant le stockage. Il a été démontré que cela implique « une dégradation aldéhyde de Strecker ». Le blanchiment provoque une oxydation de l'acide ascorbique et améliore le brunissement du produit séché à l'air chaud.
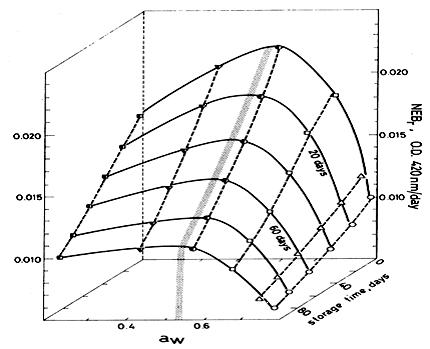
Figure 3 : Taux de brunissement non enzymatique (NEBr) du jus de pomme en fonction de l’aw et du temps de stockage. ° Brix: ,65;,70; ,75; ,81; ,84,5; 90,5. Les lignes représentent un ajustement d'équation polynomiale. La zone ombrée représente la plage maximale NEBrToribio et al [Toribio J L, Nunes R V, Lozano J E (1984) Influence of water activity on the nonenzymatic browning of applejuiceconcentrateduringstorage. J Food Sci 49 1630-1631]
d-L'effet de la température
La température a un effet majeur sur le taux de brunissement. À des températures allant jusqu'à 60 ° C, le brunissement est normalement une réaction d'ordre zéro. À des températures plus élevées, des changements peuvent suivre une réaction de premier ordre. Certains matériaux, tels que le jus de pamplemousse, présente deux phasesde célérité. Une phase de latence est suivie d'une réaction d'ordre zéro. Des études à long terme ont été menées sur la présence de brunissements dans les jus de pamplemousse et d’orange conservés dans des fûts en acier. Il a été constaté que le concentré de pamplemousse ne pouvait pas être conservé plus de 6 à 7 mois à 2 ° C et ne devait pas être exposé à des températures supérieures à 15 ° C pendant plus de quelques jours. Néanmoins, le jus d'orange était beaucoup plus résistant. Il pourrait être stocké à 2 °C pendant 18 mois avec peu d'effet, mais l'expédition ne devrait pas avoir lieu pendant les fortes chaleurs estivales. Le brunissement des jus de poire a des concentrations entre 45,2 et 72,5 ° Brixsuit un processus à cadence zéro dans la plage de températures entre 50 à 80 ° C. La variabilité des taux de brunissement pourrait être causée par la variété, les conditions de récolte et les pratiques agronomiques. Le concentré de jus produit à partir de pommes RedDelicious et Granny Smith possède des énergies d’activation similaires, mais le brunissement est plus rapide dans le premier cas. Il est à noter que le traitement thermique s'est avéré être un facteur critique pour l'obtention d'un concentré de couleur plus claire.
e-La prévention
La qualité des jus d’agrumes est affectée par le brunissement pendant le stockage. Bien que garder le jus de citron dans l'obscurité ne fasse aucune différence avec le brunissement dû au stockage, il l'est moins à des températures plus basses. Le soufre retarde le brunissement, mais ni l'acide ascorbique ni son isomère erbit ne sont utiles dans ce cas. Des études ont été effectuées sur le jus d'orange naturel et les boissons synthétiques d'orange contenant 10% de jus d'orange. Ils ont été emballés de manière aseptique et stockés dans des conditions aérobies et anaérobies. L'acide ascorbique était le constituant le plus réactif en ce qui concerne la formation de pigments brunissants. Son effet la réaction de brunissement était beaucoup plus intense en présence d'oxygène. Le brunissement a augmenté linéairement avec la concentration d'acides aminés incorporés, mais était beaucoup plus sévère en présence de fortes concentrations d'acide ascorbique. Les sulfites peuvent retarder le brunissement non enzymatique et enzymatique des fruits et des légumes transformés. De plus, la cystéine, le calcium, le dihydrogénophosphate de di-sodium et le tréhalose sont efficaces pour réduire le taux de brunissement de certains produits. Dans le cas du séchage de pommes, la cystéine n'est pas efficace pour réduire le brunissement pendant le stockage, pas plus que l'addition d'un composé de manganèse et d'étain. Le calcium offre une certaine protection, de même que l'utilisation de désoxygénants pour l'emballage. Pendant le stockage, 20 à 30% du brunissement sont non enzymatique (Maillard) et environ 60 à 70% oxydant. La dégradation des arômes par brunissement non enzymatique est courante pour les aliments séchés au cours de la transformation et du stockage. Il est probable que le type d'emballage affecte le taux de brunissement en contrôlant la quantité d'oxygène disponible pour la réaction. Cependant, le manque de brunissement des pêches emballées dans des sachets souples peut être lié à l'inertie de la couche interne du polypropylène.
III-LES COLORANTS SYNTHÉTIQUES
Les colorants alimentaires synthétiques sont disponibles sous deux formes: les colorants hydrosolubles et les laques. Les premiers, généralement commercialisés sous forme de poudre ou de granulés, ont les teneurs les plus élevées en colorant pur. Le reste est constitué d'humidité ou de diluant tel que le sel ordinaire ou la dextrine. Les colorants sont commercialisés sous de nombreuses formes telles que lespâtes et colorants de placage et dispersions, et ils peuvent aussi être mélangés avec des arômes. Les caractéristiques techniques souhaitables sont une bonne stabilité, une grande pureté, une haute valeur tinctoriale, une standardisation précise et une sécurité de manipulation. Les couleurs peuvent être rendues insolubles par précipitation sous forme de laques d'aluminium ou de calcium. Celles-ci sont plus faibles, contiennent environ 25% de couleurs et conviennent aux aliments à base de graisse et aux enrobages de comprimés. Les laques ont tendance à être plus stables vis-à-vis de la lumière et de la chaleur. Les colorants en poudre peuvent produire de la poussière, ce qui peut entraîner des problèmes de santé ou de contamination. Toutefois, ils sont commercialisés sous forme de granulés et de colorants de placage, ainsi que de pâtes et de colorants liquides, à des tailles de particules plus grandes. Les colorants peuvent également être micro-encapsulés. Il existe des méthodes de libération contrôlée qui peuvent être spécifiques à un site, à une heure ou à une étape. Sinon, leur libération peut être déclenchée par le pH, la température, l'irradiation ou un choc osmotique. De nombreuses variantes d'application de colorant sont disponibles pour s'adapter à des applications particulières. Par exemple, les colorants de placage de particules plus volumineuses confèrent un attrait visuel accru aux mélanges secs et mélanges non étincelants éliminent les traînées. Les dispersions de pigments avec du dioxyde de titane sont utilisées pour augmenter l'opacité du produit. Le tableau 3 présente les formes, les propriétés et les applications des colorants synthétiques. Les laques sont relativement inertes dans les environnements de produits pouvant inclure des ions métalliques, des pH extrêmes, une faible teneur en humidité et l'exposition du produit fini à la lumière. Des considérations de traitement à haute température peuvent conduire à un choix de laquesous forme de poudre. La migration de la couleur par lessivage se produit moins avec les laques qu'avec les colorants. Les laques conviennent mieux aux tons foncés et profonds, mais avec des tons pastel clairs, elles peuvent provoquer des taches. Le tableau 4 donne des exemples de types de produits pour lesquels les colorants et les laques conviennent. Les études publiées comprenant des examens détaillés des colorants synthétiques paraissent rarement. Dans le contexte pharmaceutique, il a été démontré que les interactions de colorants avec des gélatines dans une solution liquide-solide étaient sensibles au type de gélatine. Dans un contexte de mélange d'aliments secs, les poudres fines ont tendance à être adhésives; et forment des agglomérats structurés plutôt que d'être distribués au hasard. La migration de la poudre entre les surfaces peut poser un problème de production et affecter l’apparence de la poudre. La légèreté d'un matériau coloré augmente à mesure que sa taille de particules diminue. La réduction de taille fournit un nombre accru de limites de particules, et donc une augmentation de la diffusion de la lumière diffuse. La diffusion maximale se produit lorsque le diamètre de la particule est approximativement égal à 1 4λ, où λ est la longueur d'onde de la lumière diffusée. A ce diamètre, les particules de pigment sont les plus efficaces. En utilisation commerciale, les ingrédients colorés sont normalement accompagnés d'un support. L'affinité de surface entre les colorants synthétiques et un certain nombre de supports est importante. Le rang d'affinité est l'acide citrique (le plus élevé), l'acide malique, le saccharose et le chlorure de sodium. Dans la plage critique de l’aw entre 0,33 et 0,88, la migration de la poudre presque cesse. Cela est probablement dû à la stabilisation des agglomérats pigment-support par des ponts liquides.

Tableau 3 : Formes, propriétés et applications des colorants synthétiques adapté de Dziezak [DziezakJudie D (1987) Application of food colorants. Food Tech 41 78-88]
Lorsque la concentration du diluant est dix fois supérieure au poids du colorant, la légèreté du mélange est déterminée principalement par le diluant. Une réduction de la taille des particules de colorant augmente le nombre de centres absorbant la lumière et augmente les risques d'interaction entre la lumière incidente et le chromophore. C'est-à-dire que la légèreté du mélange va diminuer. Par conséquent, le taux de dilution et la taille des particules du diluant et du colorant peuvent être utilisés pour contrôler la couleur d'un mélange en poudre. L’application industrielle de ce principe de contrôle de la couleur est illustrée par le développement d’un sucre-caramel encapsulé pour contrôler l'étendue du brunissage lors de la cuisson aux micro-ondes. Il a été constaté qu’en sélectionnant des concentrations et des tailles de particules appropriées, il est possible de contrôler les couleurs initiale et finale, ainsi que l'uniformité du développement de la couleur.
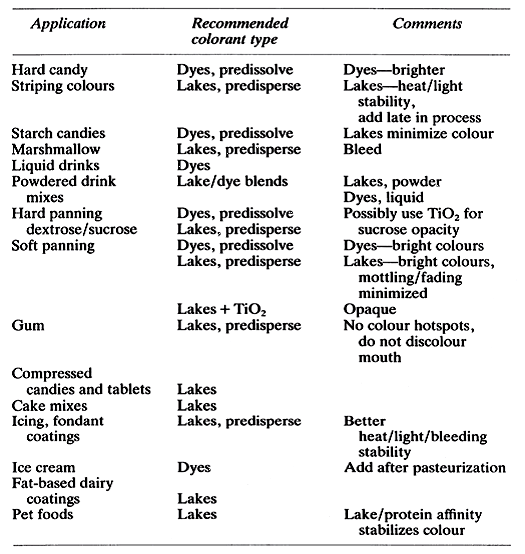
Tableau 4 : Applications typiques de produits pour colorants hydrosolubles et laques adapté de Lykens[Lykens Don (1985) Colorants and confectionery applications. The ManufacturingConfectioner 65 61-64]
IV-LISTES ET EQUIVALENTS AUTORISES DE COULEURS NATURELLES ET SYNTHETIQUES
Autrefois, de nombreuses couleurs ont été utilisées pour être incluses dans les produits alimentaires, cependant seulement une petite proportion est désormais autorisée et chaque pays a sa propre liste de colorants alimentaires réglementés. La situation internationale est complexe et même chaque pays de la Communauté européenne a sa propre liste. L'autorisation d'utiliser le colorant n'inclut pas automatiquement l'autorisation d'utiliser les laques de ces colorants, et les réglementations relatives à ces colorants varient également d'un pays à l'autre. Le tableau 5 donne un aperçu général des listes autorisées pour la Communauté européenne et les États-Unis. Le contenu de ces listes autorisées est disponible et les fabricants de produits doivent confirmer la légalité de tous les colorants utilisés dans leurs produits avant de les commercialiser.
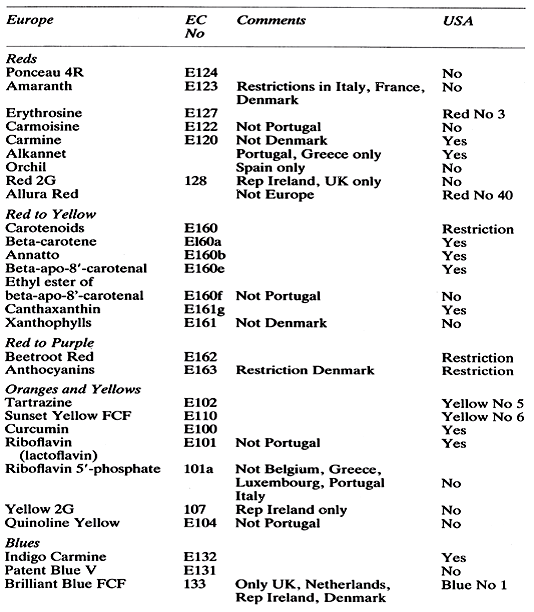
Tableau 5 : Les colorants alimentaires les plus courants: un tableau général des listes autorisées en Europe et aux États-Unis
Les ingrédients principalement utilisés comme aromatisants confèrent également une couleur comme dans le cas du safran, du paprika, du santal et du curcuma. Parmi les autres additifs agissant sur l'apparence on peut citer : a) les émulsifiants et les stabilisants de mousse, qui augmentent la diffusion de la lumière ;b) Les agents de glaçage, tels que la cire d'abeille, la cire de carnauba (dans la confiserie du sucre et du chocolat) et la gomme laque (utilisée pour cirer les pommes); c) Les agents de blanchiment; d) Les diluants de colorants; e) Les agents clarifiants pour boissons; et f) Les agents raffermissants pour les confitures et les desserts.
Des quantités relativement importantes de colorants naturels sont normalement nécessaires pour obtenir la même intensité de couleur que celle donnée par les colorants synthétiques. En effet, ceci est dû au fait que les couleurs naturelles sont utilisés sous forme non purifiée et non pas car leur force tinctoriale est intrinsèquement inférieure. D'autres limitations des colorants naturels incluent une sensibilité accrue à l'oxydation, une solubilité réduite et une sensibilité accrue à la lumière, à la chaleur et au pH. La stabilité et l’utilisation des colorants naturels en poudre de betterave rouge, cuivre chlorophylle, cochenille et anthocyane, bêta-carotène et riboflavine ont été comparées à des produits synthétiques sélectionnés. Les couleurs naturellesont été jugés relativement stables dans certaines conditions bien définies. Il a été conclu qu'ils peuvent être utilisés avec un degré de succès raisonnable, lorsque les aliments sont sélectionnés de manière à satisfaire les conditions définies ou lorsque des modifications appropriées sont apportées au processus. Les points les plus importants à prendre en compte avant d’utiliser des colorants naturels (ou autres) dans une formulation comprennent:
- La nature des couleurs possibles à utiliser.
- La nature du système alimentaire, y compris la présence de protéines, deaw, de SO2 et de conservateurs.
- La phase à colorer, eau ou huile, y compris les problèmes de limite de phase et la migration de la couleur
- Le processus de fabrication, y compris la durée, la température, les méthodes et l'ordre du mélange, l'exposition à l'oxygène et les agents de conservation.
- L'emballage, y compris les colorants d'origine animale.
- Les conditions de stockage du produit emballé, y compris l'exposition à la lumière, les températures et les durées de stockage: les essais de stockage accéléré ont tendance à donner des résultats trompeurs sur la stabilité de la couleur.
Une liste des équivalents naturels / synthétiques suggérés est donnée dans le tableau 6.

Tableau 6 : Colorants naturels potentiels à utiliser comme substituts descolorants synthétiques
















